下列各组中两个变化所发生的反应,属于同一类型的是( )
| A.由甲苯制甲基环己烷、由乙烷制溴乙烷 |
| B.乙烯使溴水褪色、乙炔使酸性高锰酸钾水溶液褪色 |
| C.由乙烯制聚乙烯、由氯乙烯制聚氯乙烯 |
| D.由苯制硝基苯、由乙醇制取乙酸乙酯 |
用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL 0.3mol·L-1的NaCl溶液和300mL 0.2mol·L-1的AgNO3溶液,当产生0.56L(标况)Cl2时,停止电解,取出电极,将两杯溶液混合,混合液的pH为(混合后溶液体积为500mL)。
| A.1.4 | B.5.6 | C.7 | D.12.6 |
已知反应:①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ/mol
下列结论正确的是
| A.碳的燃烧热110.5 kJ/mol |
| B.①的反应热为221 kJ/mol |
| C.稀醋酸与稀NaOH溶液反应的中和热为57.3 kJ/mol |
| D.稀盐酸与稀NaOH溶液反应的中和热为57.3 kJ/mol |
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H =―Q1 kJ/mol
2H2S(g)+O2(g)="2S" (s)+2H2O(l)△H =―Q2 kJ/mol
2H2S(g)+O2(g)="2S" (s)+2H2O(g)△H =―Q3 kJ/mol
Q1、Q2、Q3三者关系正确的是
| A.Q1>Q3>Q2 | B.Q1>Q2>Q3 |
| C.Q3>Q2>Q1 | D.Q2>Q1>Q3 |
在容积为2升的密闭容器中,有反应:mA(g)+nB(g) 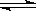 pC(g)+qD(g),经过5分钟达到平衡,此时,各物质的变化为:A减少了amol·L-1,B的平均反应速度VB=
pC(g)+qD(g),经过5分钟达到平衡,此时,各物质的变化为:A减少了amol·L-1,B的平均反应速度VB=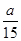 mol·L-1·min-1,C增加了
mol·L-1·min-1,C增加了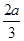 mol·L-1,这时,若增加系统压强,发现A与C的百分含量不变,则m︰n︰p︰q为
mol·L-1,这时,若增加系统压强,发现A与C的百分含量不变,则m︰n︰p︰q为
| A.1︰1︰1︰1 | B.1︰3︰2︰2 |
| C.1︰3︰2︰1 | D.3︰1︰2︰2 |
已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的
| A.X的能量一定高于M |
| B.Y的能量一定高于N |
| C.X和Y的总能量一定高于M和N的总能量 |
| D.因该反应为放热反应,故不必加热就可发生 |