在容积为2升的密闭容器中,有反应:mA(g)+nB(g) 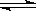 pC(g)+qD(g),经过5分钟达到平衡,此时,各物质的变化为:A减少了amol·L-1,B的平均反应速度VB=
pC(g)+qD(g),经过5分钟达到平衡,此时,各物质的变化为:A减少了amol·L-1,B的平均反应速度VB=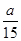 mol·L-1·min-1,C增加了
mol·L-1·min-1,C增加了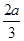 mol·L-1,这时,若增加系统压强,发现A与C的百分含量不变,则m︰n︰p︰q为
mol·L-1,这时,若增加系统压强,发现A与C的百分含量不变,则m︰n︰p︰q为
| A.1︰1︰1︰1 | B.1︰3︰2︰2 |
| C.1︰3︰2︰1 | D.3︰1︰2︰2 |
难挥发性二硫化钽(TaS2)可采用如右图装置提纯。将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
TaS2(s)+2I2(g) TaI4(g)+S2(g)
TaI4(g)+S2(g)
下列说法正确的是( )
| A.在不同温度区域,TaI4的量保持不变 |
| B.在提纯过程中,I2的量不断减少 |
| C.在提纯过程中,I2的作用是将TaS2从高温区转移到低温区 |
| D.该反应的平衡常数与TaI4和S2的浓度乘积成反比 |
向仅含Fe2+、I—、Br—的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是( )
| A.线段Ⅲ代表Fe2+的变化情况 |
| B.线段Ⅰ代表Br—的变化情况 |
C.a 数值等于6 数值等于6 |
| D.原混合溶液中n(FeBr2)="4" mol |
关于下列图示的说法中不正确的是()
| A.用图①实验装置可完成比较乙酸、碳酸、苯酚三者酸性强弱的实验 |
| B.图②表示NOx溶于水完全转化为HNO3时,x与耗氧量y之间的关系 |
| C.用图③装置可制得金属锰 |
D.图④表示可逆反应CO2 (g)+H2(g) CO(g)+H2O(g)的△H<O CO(g)+H2O(g)的△H<O |
一定温度下,有可逆反应:3Fe(s)+4H2O(g)Fe3O4(s)+4H2O;△H>O。下列说法中正确的是()
| A.降低反应温度,H2O(g)的转化率增大 |
| B.反应达到平衡后,增加Fe的量,平衡向正反应方向移动 |
| C.反应达到平衡后,t0时增大压强,V(正)、V(逆)的变化如右图所示 |
| D.在绝热密闭容器中,若体系温度不再发生变化,则说明该反应达到化学平衡 |
向某二价金属M的M(OH)2溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体,如果计算金属M的相对原子质量,你认为还必须提供下列哪项数据( )
| A.M(OH)2溶液的物质的量浓度 | B.与MCO3反应的盐酸的物质的量浓度 |
| C.MCO3的质量 | D.题给条件充足,不需要再补充数据 |