乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成。乙醇和汽油经加工处理形成的车用燃料即乙醇汽油。
结合有关知识,回答下列问题:
(1)乙醇分子中的官能团是 (填写名称)。
(2)试写出实验室用乙酸和乙醇在浓硫酸催化作用下共热反应生成乙酸乙酯的化学方程式 。
A、B、C、D、E是中学常见的几种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
回答下列问题:
(1)X的单质与A反应的化学方程式是________________________________。
(2)若C溶液显碱性,则试剂1是 ____溶液(写化学式);若C溶液显酸性,则显酸性的原因是(用离子方程式表示)。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是;
②写出D→E反应的离子方程式;
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是:。
某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 |
实验现象 |
| ①将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
| ②反应结束后分离出溶液备用。 |
|
| ③红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3]。 |
按实验中发生反应的现象写出下列化学方程式(是离子反应的只写离子方程式)
①析出疏松的红色固体;
③一段时间后固体由红色变为绿色。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是。
解释此现象的离子方程式是、。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)
。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是。
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答: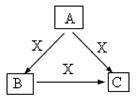
(1)若A、B、C中均含同一种常见金属元素,该元素在 C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素的原子结构示意图为。
②该金属元素的单质与某红色氧化物在高温下反应,可用于焊接铁轨及定向爆破,已知:1mol该单质完全反应,当温度恢复至298K时,共放热QkJ,请写出该反应的热化学反应方程式为。
(2)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①用化学方程式表明B溶液呈碱性的原因。
②自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为___________________。
试回答下列问题:
(1)已知24克A和40克B恰好完全反应生成0.8molC和32克D,则C的摩尔质量为。
(2)如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
①该浓盐酸中HCl的物质的量浓度为mol/L。
②若实验室配制450mL2.38 mol/L的稀盐酸,需用该浓盐酸________ mL,如下图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是______________________(填仪器名称)。
在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________2.38mol/L (填“大于”“等于”或“小于”,下同)。
某些化学反应可表示为:A+B→C+D+H2O。请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,则该反应离子方程式为____________________________________________________。
(2)若A为黑色固体,C是黄绿色气体,则该反应的化学方程式为______________________。
(3)若C为NaCl,D是能使澄清石灰水变浑浊的无色无味的气体,若A为盐,B为酸,则A是___________________或___________________ (填化学式)。
(4)若A是铁的一种氧化物,B是盐酸,则A与B反应的化学方程式为___________________。