某学生做浓硫酸性质的实验: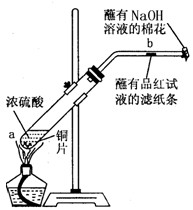
在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有NaOH溶液的棉花。加热试管,观察现象
回答下列问题:
(1)写出试管中发生反应的化学方程式 。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为 ,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为 。
(3)蘸有NaOH溶液的棉花团作用是 。
(4)硫酸型酸雨的形成过程可用下列反应中的 来表示。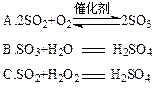
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),其过程如下:
(1)过程①中,FeS和O2、H2SO4反应的化学方程式为。
(2)过程②中产生的尾气会对大气造成污染,可选用下列试剂中的吸收。
a.浓H2SO4 b.蒸馏水 c.NaOH溶液 d.浓硝酸
(3)过程③中,需要加入的物质名称是
(4)过程④的实验操作是
(5)过程⑥中,将溶液Z加热到70~80℃,目的是。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取样品2.700 g;②将样品溶于足量盐酸后,加人足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)SO4]n,则该聚铁中铁元素的质量分数为。
实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用FeC13溶液吸收多余的SO2气体。
(1)写出SO2与FeC13溶液反应的离子方程式:。
(2)FeC13溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有:H+、Fe2+、C1—、SO42-。某同学认为还可能存在其他离子,并提出假设进行实验探究。
①提出合理假设:
假设1:还存在HSO3-、SO32-
假设2:还存在Fe3+
假设3:HSO3-、SO32-、Fe3+都不存在
②设计实验方案
| 实验步骤 |
现象和结论 |
| 步骤1:取少量吸收液于试管,滴加稀硫酸酸化,然后再滴入几滴溶液。 |
现象: 结论:假设1不成立。 |
| 步骤2: |
现象: 结论:假设2成立。 |
(3)测定空气中SO2含量的方法是:把500L含SO2气体的空气通入20mL含0.00015molKMnO4的溶液中,充分反应后,再用0.02000mol/L的KI溶液滴定过量的KMnO4,消耗KI 溶液25.00mL,则空气中的SO2含量为mg/L。
(5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,10I—+2MnO4-+16H+=2Mn2++5I2+8H2O)
绿矾(FeSO4·7H2O)可用于色谱分析剂、净水、照相制版等方面。下面是以铁屑(含少量锡等杂质)生产绿矾的一种方法:
己知:在H2S饱和溶液中,SnS沉淀完全时的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时溶液的pH为5.5。
(1)操作Ⅱ中用pH试纸测定溶液pH的操作是:
(2)操作Ⅱ中用硫酸酸化至pH=2的目的是
(3)操作Ⅲ中需要的玻璃仪器是烧杯、。
(4)通入硫化氢至饱和的目的是:①除去操作Ⅰ所得溶液中含有的Sn2+等杂质离子;
②
(5)操作IV的顺序依次为:、冷却结晶、。
(6)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②。
氯化亚铁溶液中滴加硫氰化钾溶液,再滴加双氧水,立即出现血红色,后红色又褪去呈黄色并伴有气泡产生,针对该实验现象,某实验小组的同学进行了探究
一、现象分析
假设A:气泡是H2O2分解产生的O2
假设B:气泡是KSCN被氧化为N2、SO2、CO2等
假设C:红色褪去的原因是KSCN被氧化成了其它物质
二、实验探究
探究1
| 实验操作 |
实验现象 |
结论 |
| ①1mL 0.1mol/L的FeCl2溶液中加2滴KSCN溶液 |
溶液不变红 |
Fe2+遇SCN-不变红 |
| ②向①的溶液中加3%的H2O21滴并振荡 |
立即出现血红色 振荡后不褪色 |
加入H2O2后溶液中 出现了(离子符号) |
| ③向②的溶液中继续加H2O2溶液 |
溶液中出现大量气泡 血红色褪去 |
|
| ④用带火星的木条检验③中的气体 |
木条复燃 |
则假设成立 |
探究2
| 实验操作 |
实验现象 |
结论 |
| ①取2ml KSCN溶液向其中加入几滴BaCl2溶液和稀盐酸 |
无明显现象 |
|
| ②向①所得的溶液中滴加3%的H2O2 |
溶液中出现白色沉淀并有少量气泡 |
白色沉淀为BaSO4 |
| ③将6%的H2O2溶液加入KSCN固体中,生成的气体依次通过品红溶液,酸性KMnO4溶液和澄清的石灰水 |
KSCN被H2O2氧化生成了SO2和CO2气体 |
三、问题与讨论
(1)探究1中,H2O2分解速度很快的原因
(2)探究1中,说明还原性Fe2+SCN-
(3)探究2中,酸性KMnO4溶液的作用是
能证明生成了CO2的现象是
(4)若SCN -被H2O2氧化得到N2、SO2、CO2和SO42-,且SO2与SO42-的物质的量比为1:1,试写出该反应的离子方程式
已知Fe(NO3)2受热分解产物为金属氧化物、NO2和O2,请完成表格内容并回答相关问题:
(1)对固体产物中Fe化合价的猜想:
猜想一:只显+2价猜想二:只显+3价;猜想三:。
(2)为证明猜想二通过完成下表加以验证。供选试剂有:0.01 mol/L 酸性KMnO4溶液、0.1 mol/L H2SO4溶液、3%H2O2溶液、0.1 mol/LKSCN溶液、蒸馏水。(仪器自添)
| 实验操作 |
现象 |
目的或结论 |
| 步骤1:取适量上述热分解后的固体于试管中,加入0.1 mol/L H2SO4溶液使其充分溶解,将上层清液分加到A、B两支试管中 |
溶解固体产物 |
|
| 步骤2: |
溶液中含有Fe3+ |
|
| 步骤3: |
溶液中不含 Fe2+ |
经验证,猜想二正确,请写出Fe(NO3)2热分解的化学方程式。
(3)某同学将带火星的木条伸入该分解反应产生的气体中,木条复燃,由此他得出“NO2能支持燃烧的结论”。请你判断该结论是否正确?并说明理由。