四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。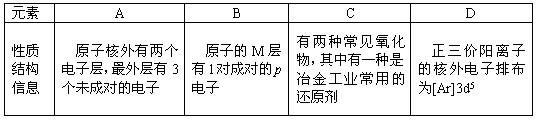
⑴写出B原子的电子排布式 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
⑶D元素的某价态阳离子可与KCN溶液形成一种俗称黄血盐的配合物甲,甲的化学式可表示为K4[D(CN)6],则中心原子D的化合价为 ,甲在水溶液中的电离方程式为 ;已知D元素的另一种价态的离子可与KCN溶液形成另一种配合物乙,乙的配位数与甲相同,则乙的化学式为 。 ⑷下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
⑷下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。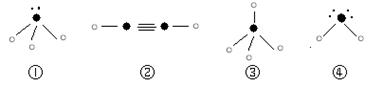
则在以上分子中,中心原子没有采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键。
某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。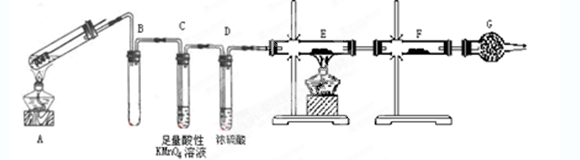
(1)填写装置的作用:B ,C,G。
(2)先点燃处酒精灯(填“A”或“E”),点燃E处酒精灯前一步操作。
(3)证明有SO2生成的现象是。
(4)反应后A的溶液中含有Fe3+和Fe2+,检验其中的Fe2+的方法是。
现有S2-、SO32-、NH4+、Al3+、HPO42-、Na+、SO42-、AlO2-、Fe3+、HCO3-、Cl-等离子,请按要求填空:
(1)在水溶液中,该离子水解呈碱性的是。
(2)在水溶液中,该离子水解呈酸性的是。
(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有。
(4)既不能在酸性较强的溶液里大量存在,又不能在碱性较强的溶液里大量存在的离子有。
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)滴定
①用______式滴定管盛装0.1000 mol/L盐酸标准液,锥形瓶中装有25.00mL待测烧碱溶液。上图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入②表空格中。
②有关数据记录如下:
| 滴定序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
||
| 滴定前 |
滴定后 |
消耗的体积 |
||
| 1 |
25.00 |
0.50 |
25.95 |
25.45 |
| 2 |
25.00 |
0.30、 |
||
| 3 |
25.00 |
6.00 |
31.55 |
25.55 |
(2)根据所给数据,计算出烧碱样品的物质的量浓度(注意保留合适的有效数字)。
c(NaOH) = _____________。
(3)读数时,若滴定前仰视,滴定后俯视,则会使最终测定结果_________。(填“无影响”、“偏高”、“偏低”)
(8分)
(1)向Na2CO3的浓溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止,则在此过程中,溶液的c(HCO)变化趋势可能是:①逐渐减小;②逐渐增大;③先逐渐增大,而后减小④先逐渐减小,而后增大。4种趋势中可能的是________。
(2)pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液各100 mL。
①3种溶液中,物质的量浓度最大的是________。
②分别用0.1 mol·L-1的NaOH溶液中和,其中消耗NaOH溶液最多的是________。
③与等量的锌粉反应,反应开始时,反应速率________。
| A.HCl最快 | B.H2SO4最快 |
| C.CH3COOH最快 | D.一样快 |
(8分)下表是不同温度下水的离子积数据:
| 温度(℃) |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
α |
1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则α________(填“<”“>”或“=”)1×10-14,作出此判断的理由是____________________________________________________________________。
(2)25 ℃下,某Na2SO4溶液中c(SO)=5×10-4 mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(SO)=________;c(Na+)∶c(OH-)=________。