陶瓷、玻璃、水泥等产品的主要成分都是
| A.硅酸盐 | B.二氧化硅 | C.硫酸盐 | D.碱性氧化物 |
下列有关电解质溶液的说法正确的是
| A.在蒸馏水中滴加浓H2SO4,KW不变 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
室温时,M(OH)2(S)  M2+(aq)+2OH-(aq) Ksp=a,c(M2+)="b" mol·L-1时,溶液的pH等于
M2+(aq)+2OH-(aq) Ksp=a,c(M2+)="b" mol·L-1时,溶液的pH等于
A.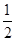 lg( lg(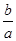 ) ) |
B.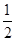 lg( lg(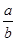 ) ) |
C.14+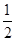 lg( lg(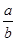 ) ) |
D.14+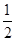 lg( lg(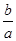 ) ) |
室温下,甲、乙两烧杯均盛有5mlpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4,关于甲、乙两烧杯中溶液的描述正确的是
| A.溶液的体积:10V甲≤V乙 |
| B.水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 |
| C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
| D.若分别与5mlpH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 |
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
| A.W2-、X+ | B.X+、Y3+ |
| C.Y3+、Z2- | D.X+、Z2- |
25℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是
| A.a=b | B.a>b |
| C.c (A-)= c(Na+) | D.c (A-)< c(Na+) |