某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图II所示。则下列结论正确的是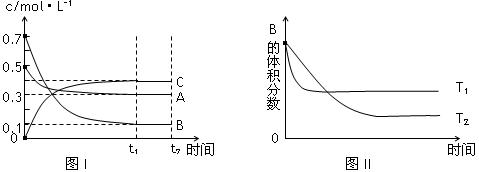
A.该反应的热化学方程式为:A(g )+3B(g) 2C(g) ;△H>0
2C(g) ;△H>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向正反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小
顺式Pt(NH3)2Cl2(式量为300)是临床广泛使用的抗肿瘤药物。下列有关该物质的说法中正确的是
| A.由4种元素组成 | B.含有NH3分子 |
| C.Pt的化合价为+4 | D.Pt元素的质量百分含量为65% |
下列叙述正确的是
| A.目前加碘食盐主要添加的是KIO3 |
| B.日常生活中无水乙醇常用于杀菌消毒 |
| C.绿色食品是不含任何化学物质的食品 |
| D.在空气质量日报中CO2含量属于空气污染指数 |
120℃、101kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为()
| A.2∶1 | B.1∶2 | C.1∶7 | D.7∶1 |
胶体区别于其它分散系的特征是()
| A.胶体粒子直径在1-100nm之间 | B.胶体粒子带电荷 |
| C.胶体粒子不能穿过半透膜 | D.胶体粒子能够发生布朗运动 |
下列实验操作中错误的是()
| A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.萃取操作时,可用苯做萃取剂,把碘水中的碘提取出来 |