某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应 A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率时间变化的如下图所示。下列说法正确的是
A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率时间变化的如下图所示。下列说法正确的是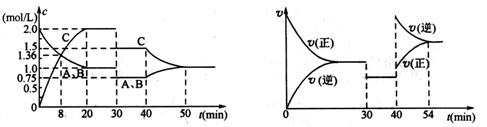
| A.8min前A的平均反应速率为0.08 mol ·L-1·min-1 |
| B.20min~40min间该反应的平衡常数为5 |
| C.30min时改变的条件是降低温度,40min时改变的条件是升高温度 |
| D.反应方程式中的x=1,且正反应为放热反应 |
下列物质按照纯净物、化合物、强电解质、弱电解质和非电解质顺序排列的是( )
| A.纯盐酸、水煤气、硫酸、醋酸、干冰 |
| B.聚氯乙烯、漂白粉、苛性钠、氢硫酸、三氧化硫 |
| C.冰醋酸、福尔马林、硫酸钡、氢氟酸、氯气 |
| D.冰水混合物、胆矾、氯化钾、次氯酸、乙醇 |
下列试剂的存放正确的是()
| A.钾、钠在空气中极易氧化,应放在水中;发生剧烈反应,盛有煤油的广口瓶中以隔绝空气; |
| B.盛放氢氧化钠溶液的瓶口用玻璃塞塞紧,不能用橡皮塞; |
| C.浓硝酸、硝酸银见光易分解,应保存在棕色细口瓶中,贮放在黑暗而且温度低的地方; |
| D.以上方法都不正确. |
在一个密闭容器中盛有11g x气体(X的摩尔质量为44g·mol-1)时,压强为1×104Pa,如果在相同温度下,把更多的气体x充入容器,使容器内的压强增至5×104Pa,这时容器内气体X的分子数约为()
| A.33×1025 | B.3.3×1024 | C.7.5×1023 | D.7.5×1022 |
下列说法中正确的是(NA表示阿伏加德罗常数)()
| A.4℃时,5.4mL水中所含的水分子数是0.3NA |
| B.在常温常压下,11.2L氯气所含的原子数为NA |
| C.标准状况下,22.4L氢气所含的质子数为2 2.4NA |
| D.2L 1mol·L-1K2SO4溶液中离子的总数为3 NA |
把氢氧化钠滴入相同物质的量浓度的硫酸铜溶液中有沉淀生成,由实验可知,氢氧化钠溶液和硫酸铜的体积比3∶2时,残留在溶液中的Cu2+的量极小(可以认为Cu2+全部沉淀)此时生成的沉淀的化学式可能是()
| A.Cu(OH)2 | B.Cu2(OH)2SO4 |
| C.CuSO4?5H2O | D.Cu4(OH)6SO4 |