某温度下0.1mol/L Na2CO3溶液中,[Na+]/[CO32—]=20/9>2,其原因是____________,现向Na2CO3溶液中通入一定量的CO2后,[Na+]/[CO32—]=5/2>20/9,其原因是_________,此时[HCO3—]=_____________。
下图所示物质(部分产物和反应条件未标出)中,只有A是单质,常温下B和 C呈气态,且B是导致酸雨的大气污染物,W是淡黄色固体。
据此回答下列问题:
(1)物质W中所含有的化学键类型为_________,其阴、阳离子个数比为_________。
(2)物质C的结构式为____________。
(3)上图反应中不属于氧化还原反应的有______________(填写序号)。
(4)写出A和X反应的化学方程式_____________;若生成的B在标准状况下的体积为 22.4L,则反应中转移电子数目为_____________。
(5)请写出C和W反应的化学方程式:_______________。
(6)请写出X和Y反应的离子方程式:_________________。
15分)有机物A、D均是重要的有机合成中间体,D被称为佳味醇(chavicol),具有特殊芳香的液体,也可直接作农药使用。下图所示的是由苯酚为原料合成A、D的流程。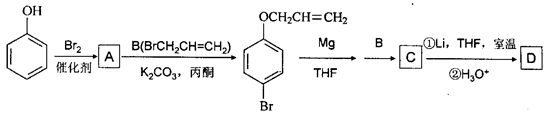
已知:
① 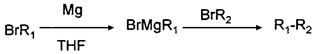 (THF为一种有机溶剂)
(THF为一种有机溶剂)
②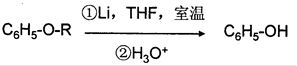
③请回答下列问题:
(1)写出A、C、D的结构简式___________、_____________、_______________。
(2) 是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有______种氢处于不同的化学环境。
是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有______种氢处于不同的化学环境。
(3)指出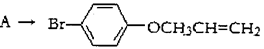 有机反应类型:___________。
有机反应类型:___________。
(4)化合物B经过下列转化,可合成用于制造树脂、合成橡胶乳液的有机原料丙烯酸。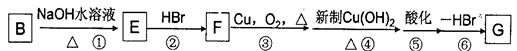
①设置反应②、⑥的目的是______________________。
②写出反应③的化学反应方程式 ___________________________。
③G与甲醇反应生成的酯H是生产丙烯酸树脂的一种重要单体,写出H聚合的化学反应方程式_____________________________。
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原予序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如图。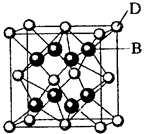
请回答:
(1)A元素的名称是________________________;
(2)B元素原子核外运动状态不同的电子数为__________,C元素原子价电子层的电子排布图为_____________,B与A形成的化合物比C与A形成的化合物沸点高,其原因是_____________;
(3)元素E在周期表中的位置是______,它的+2价离子的电子排布式为____________;
(4)由以上五种元素的任意两种形成常见化合物中,所含离子键成分最多的可能为__________(填写化学式);
(5)如图所示,D跟B形成的离子化合物晶体的密度为ag·cm-3,则晶胞的体积是_______________(只要求列出算式)。
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和 4molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___________;H2的转化率w(H2)=_________________。
②该反应的平衡常数表达式K=____________。
③下列措施中能使化学平衡向正反应方向移动的是___________(填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂D.再充入1molCO2和4 molH2
(3)25℃,1.01×10 5Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:__________________________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有_____________;其正极的电极反应式是:_____________________。
甲醇的用途广泛,摩托罗拉公司也开发出一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电.请完成下列与甲醇有关的问题.
(1)工业上用3克氢气与二氧化碳反应生成气态甲醇和水蒸气,放出24.5千焦的热量。
①请写出该反应的热化学反应方程式:
利用该反应,在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
②从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为。
③A中达到平衡时CO2的转化率为, a=。
(2)某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如题1图: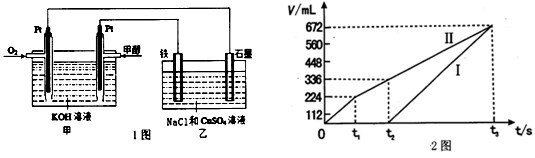
①写出甲中通入甲醇这一极的电极反应式。
②理论上乙中两极所得气体的体积随时间变化的关系如题2图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式;在t2时所得溶液的pH约为。