X、Y、Z、W均为含有10电子的微粒,W为金属阳离子,X、Y、Z常温下为气体,
(1)已知: W + X + H2O → 白色沉淀。
①若实验室用下图所示装置、干燥和收集装置制取并收集干燥的X,A中分液漏斗中的液态试剂的仪器的名称是________,仪器的连接顺序为a→________________________;
②由W离子形成的可溶性盐WCln,其水溶液显_________性,原因是(用离子方程式表示)_____________________________________________________
③为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中,_____________________________________________________
(2)常温下,取10 mLpH= a的Y的稀溶液,加水稀释时pH随溶液体积V的变化如图所示,则①Y的化学式为__________。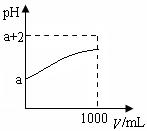
②下列有关Y的叙述正确的是__________
| A.Y溶于水后部分发生电离 |
| B.Y的水溶液中滴加石蕊试液会变红 |
| C.稀释后溶液中所有离子的浓度均减小 |
| D.稀释后,阴离子的物质的量浓度之和不变 |
③一定量X溶液和一定量的Y的溶液混合,所得溶液中离子浓度的等式关系为:
(用实际离子符号表示)
(3)已知H2的燃烧热为285.8 kJ·mol-1。现有Z和H2的混合气体共0.2 mol,与O2完全燃烧生成H2O(l)和CO2(g),转移电子的物质的量为1.0 mol,放出的热量为117.6 kJ。写出Z完全燃烧的热化学反应方程式__________________________________
亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-=== 2NO2-+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃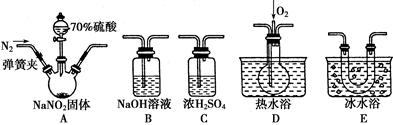
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、________、________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,目的是______________________________________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是______________________________。
②装置E的作用是__________________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的离子反应方程式为____________________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是__________________。
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:____________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_______,______________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。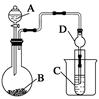
(3)仪器A的名称为________,干燥管D的作用是_____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用(选填序号)。
a.KSCN溶液和氯水b.NaOH溶液
c.浓氨水d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是。
(4)认为气体Y中还含有Q的理由是(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于(选填序号)。
a.A之前b.A-B间c.B-C间d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是。
氨气的制取及性质探究(图中夹持装置均已略去)。
(1)氮元素在周期表中的位置是;
(2)写出实验室制取氨气的化学方程式:__。
(3)如何检验烧瓶中的氨气是否已经集满?(操作、现象、结论)。
(4)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是;该实验的原理是_____ ______________。
(5)假设该喷泉实验在标准状况下进行,且喷泉结束后溶液充满了整个烧瓶(溶质没有扩散到烧瓶以外),则烧瓶中所得溶液的物质的量浓度是mol·L-1。
(13分)某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈;与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S 强,反应的离子方程式为。
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律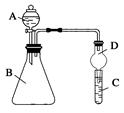
(3)仪器B的名称为,干燥管D的作用为。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气。
(5)若要证明非金属性:N>C>Si,则在A中加、B中加碳酸钙、C中加溶液观察到C中溶液________的现象,即可证明。但有的同学认为该装置有缺陷应怎样改进。