实验室用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的烧碱溶液进行反应,通过测定反应过程中的放热来计算中和热。试回答下列问题:
(1)在本实验中除了用到大烧杯、小烧杯、温度计、量筒等仪器外,还须的一种玻璃仪器名为 。
(2)两只烧杯间要填满碎纸条,其目的是 ;
(3)大烧杯上必须盖上硬纸板,否则,求得的中和热数值将 (填“偏大”、“偏小”、“无影响”)。
(4)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3,生成溶液的比热容C=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式:△H= 。
(5)实验中改用52mL 0.50mol/L的盐酸与50mL 0.55mol/L的烧碱溶液反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”)简述理由
(6)用相同浓度和体积的氨水代替烧碱溶液进行上述实验,测得的中和热的数值会 ;若改用50mL 0.50mol/L烧碱溶液进行上述实验,测得的中和热的数值会 。(填“偏大”、“偏小”、“无影响”)
某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
Ⅰ.实验装置如下图1所示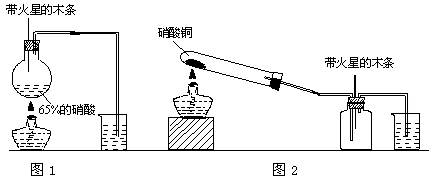
(1)浓硝酸受热分解的化学方程式是 。
(2)实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确),理由是 。
Ⅱ.实验装置如上图2所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式是 。
(2)当集气瓶中充满红棕色气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是 。
Ⅲ.为了更直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。
某化学课外活动小组,从化学手册上查得硫酸铜在500 ℃以上按下式分解:CuSO4 CuO+SO2↑+SO3↑+O2↑,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示:
CuO+SO2↑+SO3↑+O2↑,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示: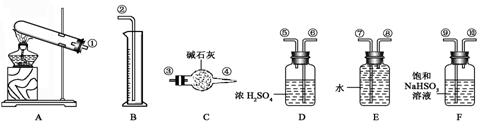
实验测得数据及有关结果如下:
①准确称取6.0 g无水CuSO4;②干燥管总质量在实验结束时增加了2.4 g;③测出量筒中水的体积后,折算成排水的气体,在标准状况下的体积为280 mL;④实验结束时,装置F中的溶液变为NaHSO4溶液(不含其他杂质,且O2在其中的损耗可忽略不计)。试回答下列问题:
(1)按装置从左至右的方向,各仪器连接顺序为(填代号)。
(2)装置F的作用是。
(3)装置D的作用是。
(4)确定装置E的进、出口的原则是:。
(5)首先应计算的是物质的体积;通过计算,推断出该条件下反应的化学方程式:
(6)该实验设计中,可能给测定带来误差最大的装置是___________________(填代号)。
某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
⑴源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成Ca(OH)2,进而发生若干复分解反应,试写出其中的一个离子方程式。
⑵加入凝聚剂可以除去其中的悬浮固体颗粒,其过程是。(填写下列各项的序号)①只有物理过程,无化学过程②只有化学过程,无物理过程③既有化学过程又有物理过程;
FeSO4·7H2O是常用的凝聚剂,加入后,最终生成红褐色胶状沉淀,则这种红褐色胶状沉淀是。用化学反应方程式表示实验室制备该胶体的方法:
⑶通入二氧化碳的目的是和。
⑷气体A的作用是。
⑸下列物质中,可以作为气体A的代替品。(填写下列各项的序号)
①ClO2②浓氨水 ③SO2④浓硫酸
某研究性学习小组研究HNO3的氧化性,设计了如下实验:
在盛有新制FeSO4溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴入几滴浓HNO3,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色快速变为蓝色,并产生红棕色气体,这一奇特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验。
⑴甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由是。
⑵乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原反应,推测可能是KSCN与HNO3作用。KSCN溶液是一种无色液体,根据C、S、N的原子结构和共价键的相关知识推测SCN-的结构式为。
⑶根据乙同学的观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀,写出向浓HNO3中滴入KSCN的离子方程式
⑷丙同学认为SCN-的性质还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均消失变为黄色,而加入碘水时溶液的颜色基本不变。丙同学的设计意图是__
⑸通过本次探究,可以得出以下结论,a、用SCN-间接检验Fe2+时应注意;b、与SCN-反应使溶液变红的是Fe3+。(填“一定”或“不一定”)
(I) 下图甲和乙是某学校王老师制备NH3 并进行性质实验时的改进装置。按图甲把仪器安装好,称取2g固体氯化铵装入试管底部,再快速称取2g氢氧化钠覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL 浓氨水);烧杯内盛滴有酚酞试液的水:把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡.
将上述中收满NH3 的圆底烧瓶取下,改装成图乙所示的装置,胶头滴管内事先预吸入2mLH2O ,此时小气球系在玻璃棒上呈自然松驰状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质。按要求回答下列问题:
(1)中学化学教材中是用与制O2相同的制备装置来加热制取NH3的,该化学方程式为:__________________________________________________________
(2)下面是某同学关于王老师能用图甲制取NH3的原因分析,有道理的是__________。
①在NH3 · H2O 中有平衡 使平衡向左移动
使平衡向左移动
②在NH3· H2O 中有平衡 使平衡向左移动
使平衡向左移动
③Na0H 溶于水时放热,使体系的温度升高,NH3的溶解度减小
④NH4Cl与NaOH 在此情况下可反应生成NH3,
⑤NH4Cl 会分解释放出NH3
(3)图甲中的NH4Cl 与NaOH 固体混合物能否用CaO 固体代替(填”能”与”不能”)
(4)如何判断图甲中烧瓶己收满NH3 ?_____________________________________________
(5)图乙中胶头滴管中的水挤入烧瓶后,观察到的现象是它说明了NH3
(Ⅱ)如上图所示:在B槽中装有500 mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中。充分反应后,试管A中余下气体的体积为0.5a mL,则原混合气体中NO2和NO的物质的量之比为
通过导气管C往余下0.5a mL气体的试管A中持续通入氧气,A中可能观察到的现象是:
___________________________________________________
有关反应的化学方程式为:___________________________________________
当试管A中充满气体时停止通入氧气,然后将试管取出水槽,则共通入氧气的体积为 ________mL,水槽B中溶液的物质的量浓度为mol·L-1(设溶液的体积仍为500 mL)