某研究性学习小组研究HNO3的氧化性,设计了如下实验:
在盛有新制FeSO4溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴入几滴浓HNO3,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色快速变为蓝色,并产生红棕色气体,这一奇特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验。
⑴甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由是 。
⑵乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原反应,推测可能是KSCN与HNO3作用。KSCN溶液是一种无色液体,根据C、S、N的原子结构和共价键的相关知识推测SCN-的结构式为 。
⑶根据乙同学的观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀,写出向浓HNO3中滴入KSCN的离子方程式
⑷丙同学认为SCN-的性质还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均消失变为黄色,而加入碘水时溶液的颜色基本不变。丙同学的设计意图是 __
⑸通过本次探究,可以得出以下结论,a、用SCN-间接检验Fe2+时应注意 ;b、与SCN-反应使溶液变红的 是Fe3+。(填“一定”或“不一定”)
熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求。试回答以下问题:
(1)在仪器:a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,标有“0”刻度的是(填序号)。
(2)蒸发皿的使用:把滤液倒入蒸发皿中,再把蒸发皿放到铁架台的铁圈上。用酒精灯加热,同时用玻璃棒不断搅拌,以防止_______________。当蒸发皿里的液体较少时,则应___________,利用余热使剩余溶剂挥发。
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体。可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。请回答下列问题:
① 若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为,制取该气体利用了B的性质有、。通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为;
② 若在乙中收集氨气,气体流经装置的顺序是:a→→→d(填接口代号)。
(4)下图中的装置D是实验室制备CO2的简易装置图,用该装置制备CO2可起到随时使反应发生,也可以随时使反应停止的效果。下图中的装置A、B、C也可起到相同效果的有(填写编号)。
(12分)亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组拟制备NaNO2并测定产品纯度。
I【查阅资料】
①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②NO能被酸性高锰酸钾氧化成NO2。
③酸性条件下MnO4-被还原为Mn2+。
Ⅱ【制备产品】
用如下装置制NaNO2(夹持和加热装置已省略)。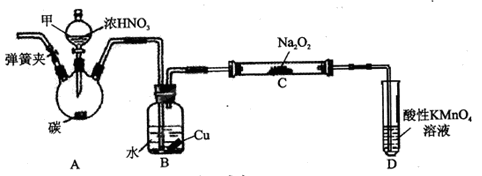
(1)装置A烧瓶中发生反应的化学方程式为_______________________。
(2)B装置的作用是_________________________。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂可能是_________。(填字母编号)
A.浓H2SO4B.碱石灰C.无水CaCl2D.生石灰
Ⅲ【测定纯度】.
设计如下方案测定产品的纯度。
(4)溶液A到溶液B发生反应的离子方程式为____________________________。
(5)取样品2.3g经一系列操作后得到溶液A100mL,准确量取10.00mL A与24.00mL 0.05mol/L的酸性KMnO4溶液在锥形瓶中充分反应。反应后溶液用0.1 mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验2次,平均消耗(NH4)2 Fe(SO4)2溶液10.00ml,则样品中NaNO2的纯度为__________。
Ⅳ【探究反思】
(6)NaNO2的纯度偏低,该小组讨论提出的原因中可能正确的是________。(填字母编号)
A.滴定至溶液紫色刚好褪去就立刻停止滴加
B.加入A与KMnO4溶液前锥形瓶未经干燥
C.实验中使用的(NH4)2 Fe(SO4)2溶液暴露在空气中时间过长
(14分)某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题: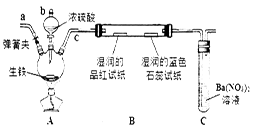
(1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称为_____________:实验过程中,装置B中观察的现象是_______________;装置C中有白色沉淀生成,该沉淀是______________(填化学式)。
(2)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:________________________。
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为_______________(填序号);然后再进行的操作是从a处多次鼓入N2,其目的是________________________________。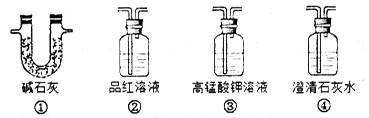
(4)某同学通过验证实验后期装置A中产生的气体中还含有H2,理由是_____________(用离子方程式表示)。
亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。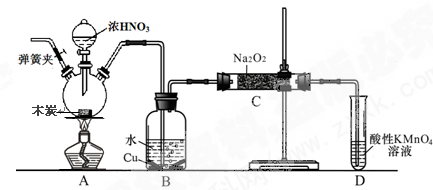
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl ="=" 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式。
(2)B中观察到的主要现象是有无色气体产生和,D装置的作用是。
(3)检验C中产物有亚硝酸钠的方法是。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭g。
(16分)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一) 探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:
A、乙醇 B、C、NaOH溶液。
(1)B中盛装的试剂(填化学式)
(2)A中加入乙醇的目的是。
(二) 探究草酸的酸性
将0.01mol草酸晶体(H2C2O4·2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是(用离子方程式表示)。
(三) 用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理:MnO4- + H2C2O4+ = Mn2+ + CO2↑+ H2O
(1)配平上述离子方程式。
(2)滴定时KMnO4溶液应盛装于(填 “酸式”或“碱式”)滴定管中。
Ⅱ、探究影响化学反应速率的因素
| 实验组别 |
c(H2C2O4) /(mol/L) |
V(H2C2O4) /ml |
c(KMnO4) /(mol/L) |
V(KMnO4) /ml |
c(H2SO4) /(mol/L) |
褪色所需时间 |
实验 目的 |
| 1 |
0.2 |
2 |
0.0025 |
4 |
0.12 |
6'55'' |
(a) |
| 0.2 |
2 |
0.005 |
4 |
0.12 |
5'17'' |
||
| 0.2 |
2 |
0.01 |
4 |
0.12 |
3'20'' |
||
| 0.2 |
2 |
0.02 |
4 |
0.12 |
9'05'' |
||
| 0.2 |
2 |
0.03 |
4 |
0.12 |
11'33'' |
||
| 0.2 |
2 |
0.04 |
4 |
0.12 |
14'20'' |
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是;
(2)根据表中数据在坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图像;
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是。