某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
⑴源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成Ca(OH)2,进而发生若干复分解反应,试写出其中的一个离子方程式 。
⑵加入凝聚剂可以除去其中的悬浮固体颗粒,其过程是 。(填写下列各项的序号)①只有物理过程,无化学过程 ②只有化学过程,无物理过程 ③既有化学过程又有物理过程;
FeSO4·7H2O是常用的凝聚剂,加入后,最终生成红褐色胶状沉淀,则这种红褐色胶状沉淀是 。用化学反应方程式表示实验室制备该胶体的方法:
⑶通入二氧化碳的目的是 和 。
⑷气体A的作用是 。
⑸下列物质中, 可以作为气体A的代替品。(填写下列各项的序号)
①ClO2 ②浓氨水 ③SO2 ④浓硫酸
焦亚硫酸钠(NA2S2O5)是常用的食品抗氧化剂之一,易被氧化为硫酸钠。某研究小组进行如下实验:采用下图装置(实验前已除尽装置内的空气)制取NA2S2O5。装置II中有NA2S2O5晶体析出,发生的反应为:NA2SO3+SO2=NA2S2O5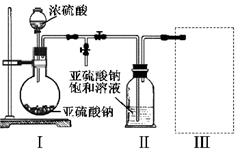
(1)装置I中产生气体的化学方程式为 。
(2)要从装置II中获得已析出的晶体,可采取的分离方法是 。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。
(4)NA2S2O5溶于水即生成NAHSO3。证明NAHSO3溶液中HSO3-的电离程度大于水解程度,可采用的方法是 (填序号)。
| A.测定溶液的pH |
| B.加入BA(OH)2溶液 |
| C.加入盐酸 |
| D.加入品红溶液 |
E.用蓝色石蕊试纸检测
(5)检验NA2S2O5晶体在空气中已被氧化的实验方案是 。
(6)葡萄酒常用NA2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了右图所示装置进行有关实验: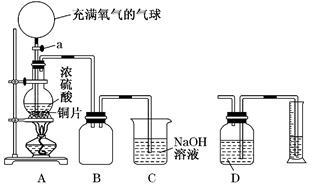
(1)先关闭活塞A,将6.4 g铜片和12 mL 18 mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余.再打开活塞A,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生反应的化学方程式:
打开活塞A之前 ;
打开活塞A之后 。
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请用文字叙述如何把导管补充完整 ;
(2)实际上,在打开活塞A之前硫酸仍有剩余。为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量。他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况)。你认为甲学生设计的实验方案中D装置中试剂为: (填化学式)。
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操配制100 mL溶液,再取20 mL于锥形瓶中,用 作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为 ;再求出余酸的物质的量,若耗去A mol/L氢氧化钠溶液B mL,则原余酸的物质的量为 mol(用含A、B的表达式来表示)。
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O),已知氯化铜易溶于水,难溶于乙醇。
(1)溶液1中的金属离子有Fe3+、Fe2+、Cu2+。能检验出溶液1中Fe2+的试剂是 (填编号)
①KMnO4
②K3[Fe(CN)6]
③NaOH
④KSCN
(2)试剂Y用于调节pH以除去杂质,Y可选用下列试剂中的(填序号) 。
A.NaOH
B.NH3·H2O
C.CuO
D.Cu2(OH) 2CO3
E.CuSO4
调节pH至4~5的原因是 。
(3)配制实验所需480mL10mol/L浓HCl时用到的玻璃仪器有:量筒、玻璃棒、烧杯、 。
(4)得到CuCl2·xH2O晶体最好采用的干燥方式是 。
A.空气中加热蒸干
B.空气中低温蒸干
C.HCl气流中加热烘干
D.HCl气流中低温烘干
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x的值,某兴趣小组设计了以下实验方案:称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得黑色固体的质量为ng。根据实验数据测得x= (用含m、n的代数式表示)。
实验室用如图所示的仪器药品制取无水氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶水化合物FeCl3+6H2O=FeCl3•6H2O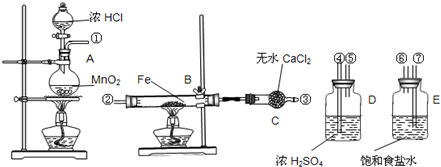
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序(①接_____,_____接_____,_____接_____;
(2)烧瓶A中反应方程式是 ,B中反应的化学方程式是_________。
(3)A、B中的酒精灯应先点燃 _ 处(填“A”或“B”(的酒精灯,理由是 _ 。
(4)这套实验装置是否完整? _ (填“是”或“否”(,若不完整还须补充 _ 装置(若第一问填“是”,则此问不需要作答(。
某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定
操作:
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL 烧碱溶液于锥形瓶中并加几滴酚酞指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
请完成下列问题:
(1)正确的操作步骤是(填写字母)__→__→__→D→__。
(2)操作D中液面应调整到_______________;尖嘴部分应_________________。
(3)以下操作会造成所测烧碱溶液浓度偏低的是()
A.酸式滴定管未用待装溶液润洗
B.碱式滴定管未用待装溶液润洗
C.锥形瓶未用待装溶液润洗
D.在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(4)该烧碱样品的纯度计算式是__________________________________________。