已知25℃时,AgI和AgCl饱和溶液中c(Ag+)分别为1.22×10-8mol·L-1和1.30×10-5mol·L-1。若在5mL含有KCl和KI浓度均为0.01mol·L-1的混合溶液中,滴加等体积等物质的量的浓度的AgNO3溶液。下列叙述不正确的是( )
| A.溶液中先产生的是AgI沉淀 |
| B.AgCl的Ksp为1.69×10-10 |
| C.混合溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| D.若在AgI悬浊液中滴加少量的KCl溶液,黄色溶液不会转变成白色沉淀 |
实验室用Zn与稀H2SO4反应来制取氢气,常加少量CuSO4来加快反应速率。为了研究CuSO4的量对H2生成速率的影响,某同学用实验比较法设计了如下实验方案,将表中所给的试剂按一定体积混合后,分别加入四个盛有相同大小的Zn片(过量)的反应瓶(甲、乙、丙、丁)中,收集产生的气体,并记录收集相同体积的气体所需的时间。
| 实验 试剂 |
甲 |
乙 |
丙 |
丁 |
| 4 mol·L-1H2SO4/mL |
20 |
V1 |
V2 |
V3 |
| 饱和CuSO4溶液/mL |
0 |
2.5 |
V4 |
10 |
| H2O/mL |
V5 |
V6 |
8 |
0 |
| 收集气体所需时间/s |
t1 |
t2 |
t3 |
t4 |
下列说法正确的是
A.t1 < t2 < t3 < t4 B.V4=V5=10 C.V6=7.5 D.V1<V2<V3<20
氯化铜的稀溶液是淡蓝色的,加入浓盐酸后,溶液变成黄绿色了,这种颜色变化是由下列可逆反应造成的:Cu(H2O)42+(溶液)+4Cl-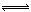 CuCl42-(溶液)+4H2O,其中Cu(H2O)42+为淡蓝色,CuCl42-为黄绿色。下列方法①加蒸馏水,②加AgNO3固体,③加入NaCl固体,④加入过量NaOH溶液中,能使溶液变成淡蓝色的是:
CuCl42-(溶液)+4H2O,其中Cu(H2O)42+为淡蓝色,CuCl42-为黄绿色。下列方法①加蒸馏水,②加AgNO3固体,③加入NaCl固体,④加入过量NaOH溶液中,能使溶液变成淡蓝色的是:
| A.只有① | B.只有② | C.①和② | D.③和④ |
下列表述中正确的是
| A.任何能使熵值增大的过程都能自发进行 |
| B.增大反应物的量,一定会加快正反应速率,使平衡向正反应方向进行 |
| C.化学平衡发生移动,平衡常数不一定发生变化 |
| D.反应物的转化率减少,平衡一定向逆反应方向移动 |
一定量的盐酸跟少量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入
| A.KNO3溶液 | B.NaCl溶液 | C.铜粉 | D.硫酸铜晶体 |
下列说法正确的是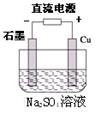
| A.Cu(s)+2H2O(l)===2Cu(OH)2 (s)+H2(g),该反应可通过上图装置来实现 |
B.在体积可变的密闭容器中进行反应:CaCO3(s) CaO(s)+CO2(g)达到平衡后压缩体积,则v(正)、v(逆)均增大,平衡向逆反应方向移动 CaO(s)+CO2(g)达到平衡后压缩体积,则v(正)、v(逆)均增大,平衡向逆反应方向移动 |
| C.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH<0,由该反应可知物质能量关系一定符合:E [ZnSO4(aq)] < E [CuSO4(aq)] |
D.在密闭容器中进行反应:HI(g)  1/2H2(g)+1/2I2(s)ΔH=-26.5 kJ·mol-1,,则充入1 mol HI,达到平衡后放出26.5 kJ的热量 1/2H2(g)+1/2I2(s)ΔH=-26.5 kJ·mol-1,,则充入1 mol HI,达到平衡后放出26.5 kJ的热量 |