(10分)(化学-有机化学基础)下图中X是一种具有水果香味的合成香料,A是有直链有机物,E能与溴水反应产生白色沉淀。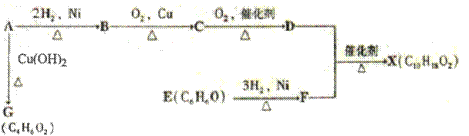
请根据上述信息回答:
(1)A中含氧官能团的名称是 ,A→G的反应类型为 。
(2)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为 。
(3)D和F反应生成X的化学方程式为 ,B到C化学反应方程式
标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂和还原剂
(1)2MnO2 + 4KOH + O2 2K2MnO4 + 2H2O
2K2MnO4 + 2H2O
氧化剂是,还原剂是
(2)3NaClO3 +10HCl(浓) 3NaCl + 4Cl2↑+ 2ClO2↑ + 5H2O
3NaCl + 4Cl2↑+ 2ClO2↑ + 5H2O
氧化剂是,还原剂是
按要求完成以下化学方程式:
(1)钠与水反应___________
(2)在光照下,次氯酸分解____________
(3)在高温下,铁与水蒸气反应_________
(4)铝与氢氧化钠溶液反应___________
某同学欲配制85mL 0.10 mol/L CuSO4溶液。
(1)若用100 mL容量瓶配制该溶液,应称取胆矾晶体(CuSO4.5H2O)的质量为g。
(2)在配制过程中,该同学已经有天平(带砝码)、药匙、100 mL容量瓶、玻璃棒、胶头滴管,要完成该实验还缺少的仪器是。
(3)下列情况中,能使所配溶液的物质的量浓度偏高的是。
| A.称量固体时将砝码放置在托盘天平左盘 |
| B.胆矾已失去部分结晶水 |
| C.转移溶液时有少量液体流出容量瓶外面 |
| D.定容时俯视刻度线 |
混合物A由KAl(SO4)2、Al2O3和FeO组成,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)D的化学式是,E的化学式是。
(2)写出①、②、④反应的离子方程式:
①;
②;
④。
(3)向溶液C中加入NaOH溶液并长期放置,能观察到的现象是。
(4)某种贫血症患者应补充溶液C中的金属阳离子。含该阳离子的药片外表包有一层特殊的糖衣,这层糖衣的作用之一就是保护该离子不被空气中的氧气氧化。验证长期放置的药片已经失效的方法是:将药片去除糖衣后研碎,取少量研碎的药片放入烧杯中,加适量的蒸馏水,__________(请补充完整),表明该药片已失效。
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
已知:①海水中溴元素(以Br-表示)的浓度0.068g/L;
②Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。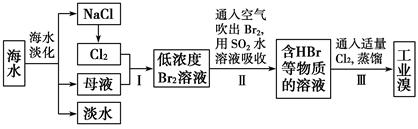
(1)请写出一种海水淡化的方法:_____________。
(2)海水中溴离子的物质的量浓度为_____________。
(3)步骤Ⅰ中已获得低溶度的含Br2溶液,步骤Ⅱ中又将Br2还原为Br-,步骤Ⅲ又得到Br2,其目的为________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为。
(5)工业溴提纯可用蒸馏法,蒸馏时加热方法最好采用,蒸馏装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_________________________________。