(14分) 阅读下表中的部分短周期主族元素的相关信息。
表:各元素的相关信息
| 元素代号 |
相关信息 |
| T |
T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X |
X的原子最外层电子数是其内层电子数的三倍 |
| Y |
在第三周期元素中,Y的简单离子半径最小 |
| Z |
T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
请回答:
(1)元素T与X按原子个数比1:1形成的化合物B所含的化学键有_____(填化学键类型)。已知在标准状况下,39g B与足量CO2反应放出Q kJ 的热量,写出该反应的热化学方程式___________________。
(2)将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式________, _________。
(3)已知1 mol 化合物A与Na2SO3在溶液中发生反应时,转移2 mol电子,写出该反应的离子方程式____________。
(4)在一定条件下,X、Y两种单质以及有孔惰性电极在化合物TZ的水溶液中可形成原电池,为新型海水航标灯提供能源,写出该原电池正极的电极反应式_____________。
(5)用惰性电极电解化合物YZ3的水溶液,写出该电解池的总化学反应方程式:______。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10 mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);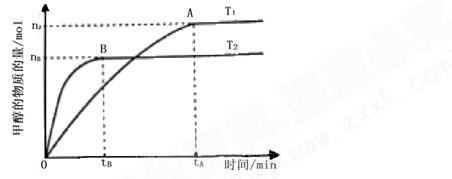
下列说法正确的是______(填序 号)
号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为 v(CH3OH)= 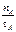 mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时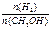 增大
增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为、正极的反应式为。
水的电离平衡如图所示.
(1)若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为
(2)将100℃时p H=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为
H=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" kJ·mol-1、c(B)="0.200" kJ·mol-1及c(C)="0" kJ·mol-1。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" kJ·mol-1、c(B)="0.200" kJ·mol-1及c(C)="0" kJ·mol-1。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件;所改变的条件分别:
②_______________;③_______________。
(2)实验②平衡时B的转化率为_________;该反应的△H _____0;(填“>”、“<”、或“=”)理由是_________________________________________。
(3)该反应进行到4.0min时的平均反应速率:
实验③:v(B)=___________________。
按下图装置进行实验,已知C1、C2为石墨棒。回答下列问题
(1)判断装置的名称:A池为___________ B池为______________
(2)锌极为__________极,电极反应式为______________________ ___;
___;
铜极为__________极,电极反应式为___________________ ______;
______;
石墨棒C1为______极,电极反应式为________________________;
石墨棒C2附近发生的实验现象为_______________________________
(3)当C2极析出224mL气体(标准状况下)时,锌的质量_________(填“增加”、“不变”或“减少”)了_________g,CuSO4溶液的质量_________(填“增加”、“不变”或“减少”)_________g。
20 L恒容的密闭容器中,加入3 mol SO3(g)和1 mol氧气,在某温度下使其反应,反应至4 min时,氧气的浓度为0.06 mol/L,当反应到8 min时,反应到达平衡。
(1)0 min~4 min内生成O2的平均速率:
v(O2)=____________mol/(L·min)。
(2)整个过程中,各物质的浓度与时间关系如下图所示,则该温度下的平衡常数K=________________。
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05 mol/L的是________,此时的平衡常数与(2)小题比较________(填“大于”、“小于”或“等于”)。
| A |
B |
C |
D |
|
| SO3 |
1 mol |
3 mol |
3 mol |
0 mol |
| SO2 |
2 mol |
1.5 mol |
0 mol |
6 mol |
| O2 |
2 mol |
1 mol |
0 mol |
5 mol |
(4)物质的浓度不再改变标志该反应已达平衡,下列还可以说明该反应已达平衡的是________(填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3)∶n(O2)∶n(SO2)=2∶1∶2