海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋 资源。试回答下列问题:
资源。试回答下列问题:
(1)海水中含有大量的氯化钠。氯化钠中的金属元素化合价为 ;除去NaCl溶液中的SO42-,可依次加入 、 和 三种溶液。
和 三种溶液。
(2)目前国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是 将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填“物理变化”、
将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填“物理变化”、 “化学变化”),蒸馏法所用的主要玻璃仪器有________________________(写三种)。
“化学变化”),蒸馏法所用的主要玻璃仪器有________________________(写三种)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
食盐+H2O NaOH+H2+Cl2(未配平)。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐 t 。
NaOH+H2+Cl2(未配平)。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐 t 。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法流程如下:
写出反应②③的化学反应方程式: , 。
酸浸法制取硫酸铜的流程示意图如下
(1)步骤①中Cu2(OH)2CO3发生反应的化学方程式为。
(2)在步骤③发生的反应中,1mol MnO2转移2mol 电子,该反应的离子方程式为。
(3)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取4.800 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
b.量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应方程式为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
b.量取25.00 mL溶液A,加入足量的NaOH溶液充分反应后,过滤、洗涤、灼烧得红色粉末0.600g。
c.另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀1.165 g。
①用Na2S2O3溶液进行滴定时,滴定到终点的颜色变化为。
②通过计算确定黄铵铁矾的化学式(写出计算过程)。
光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):
已知:A是苯甲醛
Ⅰ. (R,R′为烃基或氢)
(R,R′为烃基或氢)
Ⅱ. (R,R′为烃基)
(R,R′为烃基)
(1)C分子中所含官能团名称为。
(2)乙炔和羧酸X加成生成E,E的核磁共振氢谱为三组峰,且峰面积比为3:2:1,E能发生水解反应,则E的结构简式为。
(3)由C到D的反应类型为。
(4)D和G反应生成光刻胶的化学方程式为。
(5)C的一种同分异构体满足下列条件:
①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应;
②苯环上的一氯取代产物只有两种。
写出该同分异构体的结构简式:。
工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(已知Cd的金属活动性介于Zn和Fe之间)
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为。
(2)浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为。
该过程在空气入口处设计了一个类似淋浴喷头的装
置,其目的是。
(4)置换法除去重金属离子Cd2+,所用物质C为。
(5)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。
680℃时所得固体的化学式为。
a.ZnO b.Zn3O(SO4)2c.ZnSO4d.ZnSO4·H2O
《物质结构与性质》
铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(-NO2)还原为氨基(-NH2);在苯的溴代反应中用溴化铁作催化剂。
(1)Fe基态原子核外电子排布式为。
(2)H、N、O的电负性从小到大的顺序是。
(3)与NO2+互为等电子体的一种分子为(填化学式)。氨基(-NH2)中氮原子的杂化类型为。
(4)1mol苯分子中含有σ键的数目为。
(5)Fe与N形成的某化合物晶胞如图所示,则该晶体的化学式为。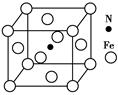
H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)空气阴极法电解制备H2O2的装置如下图所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物。
试回答:
①直流电源的a极名称是。
②阴极电极反应式为。
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下制得了H2O2。相对于电解法,该方法具有的优点是安全、。
(2)Fe3+对H2O2的分解具有催化作用。利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的(填“深”或“浅”),其原因是。
(3)用H2O2和H2SO4的混合溶液可溶解印刷电路板金属粉末中的铜。反应的离子方程式是,控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| Cu的平均溶解速率 (×10-3mol·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是。