H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)空气阴极法电解制备H2O2的装置如下图所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物。
试回答:
①直流电源的a极名称是 。
②阴极电极反应式为 。
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下制得了H2O2。相对于电解法,该方法具有的优点是安全、 。
(2)Fe3+对H2O2的分解具有催化作用。利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。
(3)用H2O2和H2SO4的混合溶液可溶解印刷电路板金属粉末中的铜。反应的离子方程式是 ,控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| Cu的平均溶解速率 (×10-3mol·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
黏土是很多硅酸盐产品的原料之一,创造历史、享誉全球的景德镇陶瓷就是利用了当地的优质黏土资源。请回答下列问题:
(1)黏土主要有效成分的化学式为Al2Si2O5(OH)4,若以氧化物形式表示,应写为____________。
(2)在黏土资源丰富的地区还可以兴建水泥厂、玻璃厂、硫酸厂等,这些工厂中属于硅酸盐工业的有__________________,玻璃厂生产雕花玻璃过程所依据的化学原理是
________________________________________(用化学方程式表示)。
(11分)已知: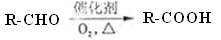
美国化学家R.F.Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。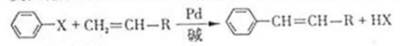
(X为卤原子,R为取代基)
经由Heck反应合成M(一种防晒剂)的路线如下: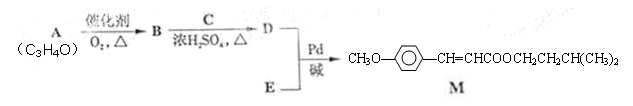
回答下列问题:
(1)M可发生的反应类型是______________。
a. 取代反应 b. 酯化反应 c. 消去反应 d. 加成反应
(2)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式是___ ____。
D在一定条件下反应生成高分子化合物G,G的结构简式是______ ____。
(3)在A→B的反应中,检验A是否反应完全的试剂是_____ __________。
(4)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。K与过量NaOH溶液共热,发生反应的方程式为_______。
(14分)Mg及其化合物可以发生如下转化(部分反应物、生成物或水已略去),已知X、Y、Z为气态单质,B常温下为液态,化合物D的焰色反应为黄色,C和G混合冒白烟并生成A,电解E的水溶液常用于某种工业生产。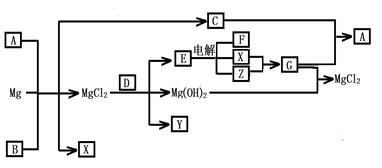
(1)写出下列物质的化学式
AY
(2)写出C的电子式
(3)写出A溶液中各离子浓度的大小顺序(由大到小)
(4)写出MgCl2与D反应的化学方程式
(5)写出电解E溶液的离子方程式
(6)将0.1molCO2通入1L溶质为F的溶液中,充分反应后,再向混合液中逐滴滴加盐酸,所加盐酸的体积与生成的气体的关系如图所示:则原F溶液的浓度为mol/L。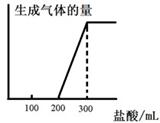
(8分)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。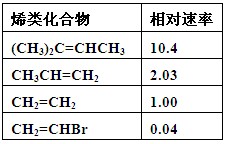
(1)下列化合物与氯化氢加成时,取代基对速率的影响与表中规律类似,其中反应速率最快的是_______________(填序号)。
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3
C.CH2="CH" CH3 D.CH2=CHCl
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3 + HBr → CH3CHBrCH3+ CH3CH2CH2Br
(主要产物)(次要产物)
CH2=CHCH2CH3+ H2O  CH3CH(OH)CH2CH3+ CH3CH2CH2CH2OH
CH3CH(OH)CH2CH3+ CH3CH2CH2CH2OH
(主要产物)(次要产物)
a. 请写出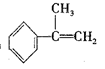 与HBr反应的主要产物的结构简式___________________。
与HBr反应的主要产物的结构简式___________________。
b. 下列框图中B、C、D都是相关反应中的主要产物(部分条件、试剂被省略),且化合物B中仅有四个碳原子、一个溴原子、一种氢原子。框图中,C的结构简式为________________________;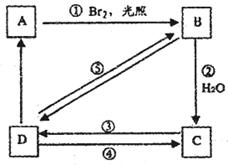
写出反应⑤的化学方程式(只写主要产物,标明反应条件):__________________________________ 。
根据下列的有机物合成路线回答问题:
(1)写出A、B的结构简式:
A 、B 。
(2)写出各步反应类型:
①、②、③。
(3)写出②、③的反应方程式:
②,
③。