(8分)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。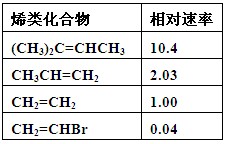
(1)下列化合物与氯化氢加成时,取代基对速率的影响与表中规律类似,其中反应速率最快的是_______________(填序号)。
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3
C.CH2="CH" CH3 D.CH2=CHCl
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3 + HBr → CH3CHBrCH3 + CH3CH2CH2Br
(主要产物) (次要产物)
CH2=CHCH2CH3 + H2O 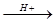 CH3CH(OH)CH2CH3 + CH3CH2CH2CH2OH
CH3CH(OH)CH2CH3 + CH3CH2CH2CH2OH
(主要产物) (次要产物)
a. 请写出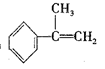 与HBr反应的主要产物的结构简式___________________。
与HBr反应的主要产物的结构简式___________________。
b. 下列框图中B、C、D都是相关反应中的主要产物(部分条件、试剂被省略),且化合物B中仅有四个碳原子、一个溴原子、一种氢原子。框图中,C的结构简式为________________________;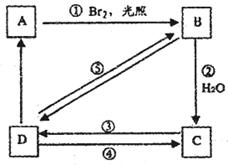
写出反应⑤的化学方程式(只写主要产物,标明反应条件):__________________________________ 。
工业上由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。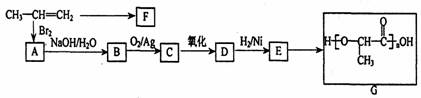
(1)聚合物F的结构简式是;
(2)D转化为E的化学方程式是;A转化为B的反应类型是。
(3)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是。
(4)写出3种含有一个羟基、一个酯基的E的同分异构体的结构简式:
、、。
(1)一个体重50 kg的健康人身体中含铁2 g。铁在人体中不是以游离态的形式存在,而是以Fe2+和Fe3+形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的Fe3+转化为Fe2+,利于铁的吸收。人体中经常进行Fe2+和Fe3+的转化,反应中,Fe2+作剂,Fe3+作剂。“服用维生素C,可使食物中的Fe3+转化为Fe2+”,说明维生素C在反应中做剂,具有性。
(2)在热的稀硫酸溶液中溶解了11.4 g FeSO4。当加入50 mL 0.5 mol/L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
FeSO4 + KNO3 + H2SO4 =K2SO4 + Fe2(SO4)3 + NxOy + H2O
①配平该化学方程式,用单线桥标出电子转移的方向和数目。
②反应中氧化剂为,x=,y=
(3)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是。
白磷(P4)是正四面体构型的分子,当与氧气作用形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键再结合一个氧原子。化学反应可视为旧键断裂和新键形成的过程。现提供以下化学键的键能(kJ/mol)。P-P键:198 kJ /mol ;P-O键:360 kJ /mol ;O=O键:498 kJ /mol ;P=O键:585 kJ /mol。试根据这些数据,计算出以下反应的反应热:P4(S,白磷)+ 5O2(g)= P4O10(s);
ΔH=。
已知有以下物质相互转化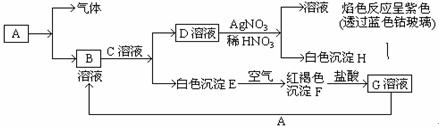
试回答:(1)写出B的化学式,D的化学式。
(2)写出由E转变成F的化学方程式。
(3)写出用KSCN鉴别G溶液的离子方程式;向G溶液加入A的有关离子反应方程式。
有A、B、C、D、E五种化合物,其中A、B、C、D是含铝元素的化合物,F是一种气体,标准状况下相对于空气的密度为1.103。它们之间有下列的转化关系:
①A+NaOH→D+H2O②B→A + H2O③C+ NaOH→B+NaCl④E+ H2O→NaOH+F
+ H2O③C+ NaOH→B+NaCl④E+ H2O→NaOH+F
⑴写出A、B、C、D的化学式:
A,B,C,E 。
。
⑵写出①③④的离子方程式:
①,
③,
④。