(1)将下列科学家与他们的原子结构模型用线连接起来: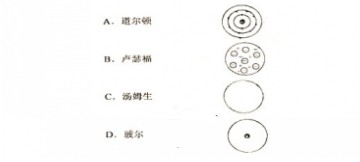
原子结构发展阶段的历史顺序是(用序号A、B、C、D填写) 
(2)原子结构的演变过程表明 (多项选择,选填序号)
A.人类对某一事物的认识是无止境的,是发展变化的。
B.现代原子结构已经完美无缺,不会再发展。
C.科学技术的进步,推动了原子学说的发展。
D.科学理论的发展过程中的不完善现象在许多科 学领域都存在,随着科学的不
学领域都存在,随着科学的不 断发
断发 展将会得到补充和完善。
展将会得到补充和完善。
(3)在打开原子结构大门的过程中,科学家运用了许多科学方法,除模型方法外,请从下列方法中选择出人们在认识原子结构过程中所运用的科学方法 (多项选择,填写序号)
① 实验方法 ②假说方法 ③ 类比方法 ④推理方法
25℃时,①醋酸②次氯酸③氢氟酸的电离常数分别是1.8×10-5、3.0×10-8、3.5×10-4。请推测:
(1)它们的酸性由强到弱的顺序为______________________(填序号,下同),
(2)相同浓度的溶液中,氢离子浓度最大的是___________;
(3)氢离子浓度相同的溶液中,酸的浓度最大的是。
把煤作为燃料可以通过下列两种途径:
途径I:C(s)+O2(g) CO2(g) ΔH=E1 ①
CO2(g) ΔH=E1 ①
途径II:先制水煤气:C(s)+H2O(g)===CO(g)+H2(g) ΔH=E2②
再燃烧水煤气:H2(g)+1/2O2(g) H2O(g) ΔH=E3③
H2O(g) ΔH=E3③
CO(g)+1/2O2(g) CO2(g) ΔH=E4④ ,试回答下列问题:
CO2(g) ΔH=E4④ ,试回答下列问题:
(1)判断两种途径放热:途径I放出的热量 _____(填“大于”、“等于”、“小于”)途径II放出的热量。
_____(填“大于”、“等于”、“小于”)途径II放出的热量。
(2)E1、E2、E3、E4的数学关系式 是_____________________________________。
是_____________________________________。
(3)由于制取水煤气反应里,反应物所具有的总能量_______(填“大于”、“等于”、“小于”)生成物所具有的总能量,正反应又是熵增加的反应,为了让该反应自发进行,要使反应条件为_______。
苯乙烯是一种重要的化工合成原料。现由苯乙烯合成聚三溴代苯乙烯和另外一种高聚物M的工艺如下:
已知:苯环上的取代反应有如下定位规律:当苯环上已经有了一个取代基时,新引进的取代基因受原取代基的影响而取代其邻、对位或间位的氢原子。使新取代基进入它的邻、对位的取 代基有—R(烷基)、—NH2等;使新取代基进入间位的取代基有—COOH、—NO2等;
代基有—R(烷基)、—NH2等;使新取代基进入间位的取代基有—COOH、—NO2等;
(1)D是高分子化合物,写出D的结构简式______________。
(2)①②③④⑤反应中属于取代反应的是________;
反应⑧的类型为________ 。
(3)设计反应①、③的目的是_______
(4)写出下列反应的化学方程式
反应③:________
反应⑦:________
(5)G有多种同分异构体,写出任意一个符合下列条件的同分异构体的结构简式________ 。
①能发生银镜反应;②能与FeCl3溶液发生显色反应;
③核磁共振谱氢图中出现6组吸收峰。
工业上合成氨的反应是:N2(g)+3H2(g)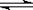 2NH3(g) ΔH=-92.20 kJ·mol-1。
2NH3(g) ΔH=-92.20 kJ·mol-1。
(1)下列事实中,不能说明上述可逆反应已达到平衡的是________
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N—H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1︰3︰2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0 |
0.20 |
N2 |
1.00 |
1.00 |
根据表中数据计算:
①反应进行到2小时时放出的热量为________
②0~1小时内N2的平均反应速率________ mol·L-1·h-1;
③此条件下该反应的化学平衡常数K="" ________(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向________方向移动(填“正反应”或“逆反应”、“不移动”)。
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行右图实验(图中所用电极均为惰性电极): 
(1)对于氢氧燃料电池中,下列表达不正确的是________
| A.a电极是负极,OH-移向负极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=________(溶液体积变化忽略不计)