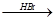有效地利用现有新能源和开发新能源已受到各国的重视。
(1)可用改进汽油组成的办法来改善汽油的燃烧性能。例如,在汽油中加入乙醇来生产“无铅汽油”。乙醇的分子式为C2H6O,试根据C、H、O成键的特点,写出C2H6O所有可能的结构式或结构简式 。
(2)天然气的主要的成分是甲烷,其燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一。能说明甲烷是正四面体而非正方形平面结构的理由是 。(填写编号)
①其一氯取代物不存在同分异构体 ②其二氯取代物不存在同分异构体
③其三氯取代物不存在同分异构体 ④其四氯取代物不存在同分异构体
(3)氢能是人类未来的理想能源。1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h 的速度行驶了40km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下列既可行又经济的制氢方法是 (填写编号)
的速度行驶了40km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下列既可行又经济的制氢方法是 (填写编号)
①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制得纯氢气后,还需要解决的问题是 。(写出其中的一个) (4)今有两个氢气燃烧生成水的热化学方程式
(4)今有两个氢气燃烧生成水的热化学方程式 2H2(g)+ O2(g) ="=" 2H2O(g) △H=a kJ/mol
2H2(g)+ O2(g) ="=" 2H2O(g) △H=a kJ/mol 2H2(g)+ O2(g) ==2H2O(l) △H=b kJ/mol
2H2(g)+ O2(g) ==2H2O(l) △H=b kJ/mol
请回答下列问题:(提示:︱b︱表示b的绝对值) ①若2 molH2完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)︱b︱kJ
①若2 molH2完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)︱b︱kJ
② 若已知拆开1mol氢气中的化学键要消耗436 kJ能量,拆开1mol氧气中的化学键要
若已知拆开1mol氢气中的化学键要消耗436 kJ能量,拆开1mol氧气中的化学键要 消耗496kJ能量,水蒸气中1molH—O键形成时放出热量463kJ,写出该反应的热化学方程式:
消耗496kJ能量,水蒸气中1molH—O键形成时放出热量463kJ,写出该反应的热化学方程式:

(本题共12分)氯酸镁[ Mg(ClO3)2 ]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
38.加速卤块在KMnO4溶液中溶解的措施有:(写出一点即可)。
39.加入MgO的作用是;过滤后所得滤渣的主要成分为。
40.加入NaClO3饱和溶液后发生反应的化学方程式为,再进一步制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;②;③;④过滤洗涤。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点。此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次
41.①写出步骤2中发生反应的离子方程式:;
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果(填“偏大”、“偏小”或“不变”);
42.若平均消耗K2Cr2O7溶液15.00 mL,则产品中Mg(ClO3)2·6H2O的质量分数为。
(本题共12分)葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→ (C6H11O7)2 Ca (葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 |
葡萄糖酸钙 |
葡萄糖酸 |
溴化钙 |
氯化钙 |
| 水中的溶解性 |
可溶于冷水 易溶于热水 |
可溶 |
易溶 |
易溶 |
| 乙醇中的溶解性 |
微溶 |
微溶 |
可溶 |
可溶 |
实验流程如下:
请回答下列问题:
32.第②步中所加CaCO3还发生了其他反应,写出其中一个主要反应的方程式________;充分反应后CaCO3固体需有剩余,目的是______________________;
33.第③步需趁热过滤,原因是______________________;
34.第④步加入乙醇的作用是______________________;
35.第⑥步中,下列洗涤剂最合适的是________。
A.冷水B.热水C.乙醇D.乙醇-水混合溶液
锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂,对婴儿及青少年的智力和身体发育有重要作用。工业上以葡萄糖酸钙为原料通过如下两步制备葡萄糖酸锌:
步骤1:充分反应后,过滤除去CaSO4沉淀。步骤2:将葡萄糖酸溶液与ZnO混合。
36.步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是。
37.下列物质可替代ZnO的是(填字母)。
a.NH3·H2O
b.Zn(OH)2
c.NaOH
d.ZnSO4
e.ZnCO3
(本题共12分)氯化钙是典型的离子型卤化物。完成下列填空:
28.氯原子核外电子排布式为,其原子核外能量不同的电子有种,最外层上有种不同运动状态的电子,钙元素在元素周期表中位于。
某研究小组以CaCl2和H2为原料,试图制备+1价Ca的化合物,结果发现产物中只有两种化合物甲和乙。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.29%、46.41%;已知甲与水反应可得H2,乙的水溶液显酸性。
29.该研究小组是否成功制得了+1价Ca的化合物?(填“是”或“否”)。甲的化学式是。
30.写出甲与水反应得H2的化学方程式。现欲检验该反应所得溶液中是否含有Cl-,请简述检验的方法。
31.乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是。
(本题共12分)合成氨是人类科学技术发展史上的一项重大突破,解决了地球上因粮食不足而导致的饥饿与死亡。
23.氨分子的电子式为_________,氮元素原子最外层电子排布的轨道表示式是________。
24.在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g),反应中NH3的物质的量浓度的变化情况如下图:
2NH3(g),反应中NH3的物质的量浓度的变化情况如下图:
根据上图,计算从反应开始到平衡时,氢气的平均反应速率为___________________。
25.催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式:;该反应中氧化产物与还原产物的物质的量之比为。
26.pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m________n(填“>”、“<”或“=”);
27.氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,易引起爆炸。为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为。该工艺选择氯气的优点是。(答出一点即可)
(本题共12分)已知: (X为卤原子,M为烃基或含酯基的取代基等)
(X为卤原子,M为烃基或含酯基的取代基等)
由有机物A合成G(香豆素)的步骤如下: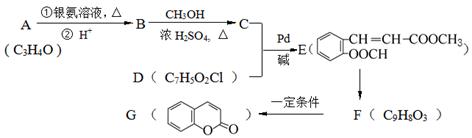
回答下列问题:
47.写出反应C+D→E的反应类型 。
48.A中官能团名称为;写出反应条件:E→F。
49.写出结构简式:B,D。
50.F有多种同分异构体,写出同时满足下列条件的任意两种同分异构体的结构简式:。
① 分子中除苯环外,无其它环状结构;
② 分子中有四种不同化学环境的氢原子;
③ 能发生水解反应,不能与金属钠反应;
④ 能与新制Cu(OH)2按物质的量之比1:2反应。
51.二氢香豆素(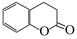 )常用作香豆素的替代品。鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品。鉴别二氢香豆素和它的一种同分异构体(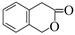 )需要用到的试剂有:NaOH溶液、。
)需要用到的试剂有:NaOH溶液、。
52.已知: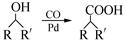 (R,R′为烃基)。试写出以苯和丙烯(
(R,R′为烃基)。试写出以苯和丙烯( =CH—CH3)为原料,合成
=CH—CH3)为原料,合成 的路线流程图(无机试剂任选)。合成路线流程图示例如下:
的路线流程图(无机试剂任选)。合成路线流程图示例如下: