(本题共12分)氯酸镁[ Mg(ClO3)2 ]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
38.加速卤块在KMnO4溶液中溶解的措施有: (写出一点即可)。
39.加入MgO的作用是 ;过滤后所得滤渣的主要成分为 。
40.加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;② ;③ ;④过滤洗涤。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7 溶液滴定剩余的Fe2+至终点。此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次
41.①写出步骤2中发生反应的离子方程式: ;
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果 (填“偏大”、“偏小”或“不变”);
42.若平均消耗K2Cr2O7 溶液15.00 mL,则产品中Mg(ClO3)2·6H2O的质量分数为 。
某有机物A(只含C、H、O)是一种重要化工生产的中间体,其蒸气密度是相同状况下氢气密度的83倍。试根据下列信息回答相关问题:
①A分子中碳原子总数是氧原子总数的3倍,其苯环上只有一个取代基,且取代基碳链上无支链;
②A可与NaHCO3溶液作用,产生无色气泡;
③A在一定条件下可与乙酸发生酯化反应。
请写出:
(1)A的分子式;A的一种可能的结构简式;
A中含氧官能团的名称。
若有机物A存在如下转化关系(见下框图),请据此时A的结构回答(2)、(3)、(4)问: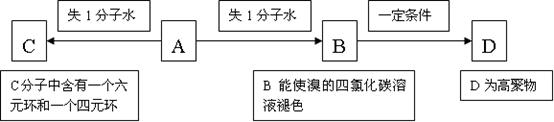
(2)请写出: A→C和B→D的化学反应方程式(注明反应条件),并注明反应类型:
A→C:,反应类型:;
B→D:,反应类型:。
(3)A的一种同分异构体F,其苯环上有两个相邻的取代基,且能与三氯化铁溶液发生显色反应。F在稀硫酸存在下水解生成G和H,其中H俗称“木精”,是饮用假酒过程中致人失明、甚至死亡的元凶。
请写出F的结构简式:。
(4)已知H在一定条件下可被氧化成K,K的水溶液常用作防腐剂,请写出:
H→K的化学方程式:。
甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题: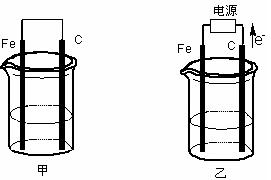
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的棒;乙池中的棒。
②在乙池中阳极的电极反应式是。
(2)若两池中均盛放饱和NaCl溶液。
①写出乙池中发生总反应的离子方程式。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则溶液混匀后的pH= 。
某种芳香族化合物A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是。
(2)已知:
ⅰ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ. 
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去。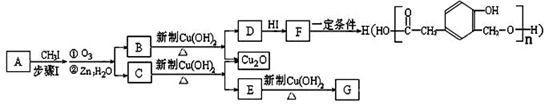 请回答:
请回答:
①步骤Ⅰ的目的是;
②若G的相对分子质量是44,则E的结构简式是;
③ F→H的反应类型是;
④ F在一定条件下可发生分子内酯化反应,生成含七元环结构的M。请写出该反应的化学方程式;
⑤A的结构简式是;
上述转化中B→D的化学方程式是。
(3)已知A的某种同分异构体N具有如下性质:
①N与FeCl3反应,溶液呈紫色;
②N在一定条件下可发生银镜反应,N与H2在苯环侧链上按照物质的量之比1:1作用后的生成物不能发生消去反应;
③在通常情况下,1molN最多能与1molBr2(浓溴水)发生取代反应;
④N分子中苯环上的取代基上无支链且只有三个支链;
N可能的结构有______种,请写出其中一种的结构简式。
(13分) 物质A、E、F的焰色反应呈黄色,物质I的分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示: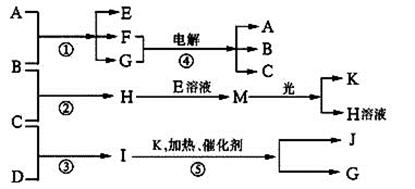
请填写下列空白:
(1)写出下列物质的化学式:B:;J:_________。
(2)写出下列反应的方程式:
反应①的离子方程式: 。
反应⑤的化学方程式:。
(3)在通常状况下,若1 gC气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为:。
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。
请回答下列问题:
(1)B、D在周期表中同处在_____族,D的原子结构示意图是,下列可以验证B与D两元素原子得电子能力强弱的实验事实是(填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的原子的电子层数
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢化合的难易
(2)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式;
(3)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有l0个电子,则甲与乙反应的离子方程式为;
(4)D元素的气态氢化物和其低价氧化物所发生的反应中氧化产物与还原产物的物质的量之比为。