(17分)硫及其化合物有广泛应用。
(1)硫酸生产过程中涉及以下反应。已知25℃、l0l kPa时:
(i)2SO2(g)+O2(g)+2H2O(l)=2H2SO4(l)ΔH=-457kJ/mol
(ii)SO3(g) +H2O(l)=H2SO4(l)ΔH=-130kJ/mol
则SO2催化氧化反应中,每生成l mol SO3(g)的焓变为_____kJ·mol-1。
(2)对于SO3催化氧化反应:2SO2(g)+O2(g)  2SO3(g)。
2SO3(g)。
①甲图是SO2催化氧化反应时SO2(g)和SO3(g)的浓度随时间的变化情况。反应从开始到达到平衡时,用O2表示的平均反应速率为____。
②在一容积可变的密闭容器中充入20mol SO2(g)和l0 mol O2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图所示。则P1与P2的大小关系是P1____ P2(填>、=或<);A、B、C三点的平衡常数大小关系是____(用KA、KB、KC和 >、=、<表示)。
(3)为研究H2SO4生产中SO3催化氧化时温度对SO2平衡转化率的影响,进行如下试验。取100 L原料气(体积分数为SO27%、O2 11%、N282%)使之发生反应,在10l kPa下达到平衡,得到如下数据:
根据上述数据,575℃达平衡时,SO3的体积分数为______%(保留一位小数)。
(4)工业生成硫酸过程中,通常用氨水吸收尾气。
①如果相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为__________,所得溶液中c(H+)-c(OH-)=___________(填序号)。
A.c(SO32-)-c(H2SO3) B.c(HSO3-)+c(SO32-)-c(NH4+)
C.c(SO32-)+c(NH3∙H2O)-c(H2SO3) D.c(HSO3-)+2c(SO32-)-c(NH4+)
②工业上用足量氨水吸收硫酸工业废气。吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性,则吸收Cl2后的溶液中一定存在的阴离子有OH-和_____。
铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。有关含铬化合物的相互转化关系如下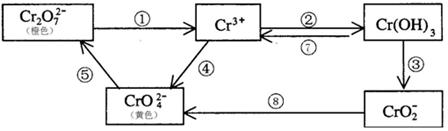
回答下列问题:
(1)铬原子的电子排布式
(2)上述反应中需用氧化剂的是(填编号)。
(3)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,写出以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应和溶液中进行的反应的离子方程式 阳极 阴极
溶液中
(4)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式
(5)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是
用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品,所用主要仪器是。
(2)将样品配成250mL待测液,需要的仪器有。
(3)取10.00mL待测液,用量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时手旋转式滴定管的玻璃活塞,手不停地摇动锥形瓶,两眼注视,直到滴定终点。
(5)根据下列数据,计算待测烧碱溶液的浓度:。
| 滴定次数 |
待测液体积 (mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.40 |
| 第二次 |
10.00 |
4.00 |
24.10 |
(6)根据上述各数据,计算烧碱的纯度;。
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题: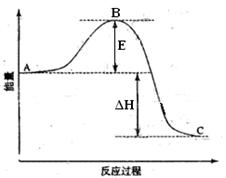
(1)图中A、C分别表示、,E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是;
(2)图中△H=KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=mol·L-1·min-1、υ(SO3)=mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H(要求计算过程)。
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有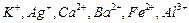 ,
, 阴离子有
阴离子有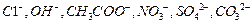 ,现将它们分别配成
,现将它们分别配成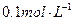 的溶液,进行如下实验:
的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加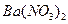 溶液,无明显现象;
溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是
;
(2)E溶液是,判断依据是
;
(3)写出下列四种化合物的化学式:A、C、
D、F.
有五种短周期主族元素A、B、C、D、E,已知:五种元素原子序数依次增大,其中A、E的单质在常温下是气体,B元素原子的最外层电子数是电子层数的2倍,D元素的单质常用于野外焊接铁轨,C元素是所在周期主族元素中原子半径最大的一种。
(1)试写出A、B两种元素形成的不含有非极性键的化合物的电子式:;
(2)试写出工业上用电解方法冶炼D单质的化学方程式;
(3)写出C单质在空气中燃烧的化学方程式,并标出电子转移的方向和数目:;
(4)写出实验室制取单质E的化学方程式:。