氨气是生产氮肥、硝酸、纯碱等的重要原料。
(1)实验室模拟合成氨。在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料(单位是mol /L),平衡时测得甲容器中H2的转化率为20%。
| |
N2 |
H2 |
NH3 |
| 甲 |
1 |
3 |
0 |
| 乙 |
0.5 |
1.5 |
1 |
| 丙 |
0 |
0 |
4 |
①平衡时甲容器中氨气的浓度为 。
②乙容器中开始反应时,v逆 v正(填<、>或=)。
③达平衡时,甲、乙、丙三容器中NH3的体积分数由大到小的顺序为 。
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ |
165 |
175 |
185 |
195 |
| K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变ΔH_____0(填“>”、“<”或“=”)。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
③右图中的B点处,NH3的平衡转化率为 。
(12分)汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
(1)装置Ⅰ中,NaOH溶液吸收SO2也可生成Na2SO3和NaHSO3的混合溶液
①写出NaOH溶液吸收SO2生成等物质的量的Na2SO3和NaHSO3混合溶液时总反应的离子方程式 。
②已知混合液pH随 :n(
:n( )变化关系如下表:
)变化关系如下表:
 |
91:9 |
1:1 |
9:91 |
 |
8.2 |
7.2 |
6.2 |
当混合液中 时,c(Na+) c(HSO3-)+ 2c(SO32-)(填“>”“=”或“<”)
时,c(Na+) c(HSO3-)+ 2c(SO32-)(填“>”“=”或“<”)
(2)装置Ⅱ中,酸性条件下,NO被Ce4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO2-的离子方程式 ;
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
①生成的Ce4+从电解槽的 (填字母序号)口流出;
②生成S2O42 - 的电极反应式为 ;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要使1m3该溶液中的NO2- 完全转化为NO3-,至少需向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示)
【改编】【化学——选修3物质结构与性质】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与D可形成正四面体形分子,C元素原子的最外层有3个自旋方向相同的未成对电子,E的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 。
(2)D所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B的气态氢化物分子呈 形。该分子的中心原子的杂化方式为 。A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与化合物BD是等电子体,根据等电子体原理,写出化合物BD的电子式
(4)B元素可形成多种单质,一种晶体结构如图一所示;另一种的晶胞如图二所示,该晶胞的空间利用率为 (保留两位有效数字)。( )
)
(5)E元素形成的单质,其晶体的堆积模型为 ,E的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(6)向E的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式 。
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为 。
(2)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
①298k时,该反应的平衡常数为 L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时
③若反应在398K进行,某时刻测得n(NO2)="0.6" moln(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点。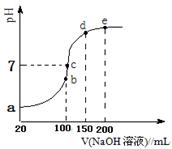
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序 。
③d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料。
(1)铝元素在元素周期表中的位置是 。
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。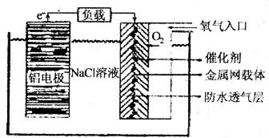
①该电池的总反应化学方程式为 ;
②电池中NaCl的作用是 。
③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为 。
④某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为
(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为 。
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式 。
【化学——选修5:有机化学基础】避蚊酯(DMP)是一种塑化剂,相对分子质量为194,摄入后对人体有一定的危害,其结构可表示为 (其中R为烃基)。实验室由以下方法可得到DMP:
(其中R为烃基)。实验室由以下方法可得到DMP:
请回答:
(1)DMP的结构简式为 ,物质C中官能团的名称为 。
(2)下列有关DMP的说法可能正确的是 。(填字母标号)
A.DMP分子的核磁共振氢谱图中有六个峰
B.DMP可以发生取代、加成、氧化等反应
C.DMP在水中的溶解度不大
(3)B与乙二酸( )在一定条件下可以按物质的量1:1发生反应生成高分子化合物,反应的化学方程式为 。
)在一定条件下可以按物质的量1:1发生反应生成高分子化合物,反应的化学方程式为 。
(4)工业上以邻二甲苯( )为原料先生产苯酐
)为原料先生产苯酐 ),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为 。
),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为 。
(5)芳香化合物E与C互为同分异构体,若1mo1E与足量银氨溶液反应最多只能析出2mo1 Ag,则E可能的结构简式为 。B也有多种同分异构体,符合以下条件的B的同分异构体有种 。
①1mo1有机物可以与2mo1NaOH反应
②苯环上的一氯代物只有一种