选做【化学—化学与技术】工业上一种制备氯化铁及高铁酸钾的工艺流程如下:
(1)吸收塔中的吸收剂X是 ;从副产物FeCl3溶液中获得FeCl3·6H2O的操作是 、加热浓缩、再冷却结晶。
(2)用FeCl3溶液(副产物)腐蚀印刷线路板所得的废液中含FeCl3、FeCl2和CuCl2,用化学方法可以回收废液中铜;合并过滤后的剩余液体可以作为上述工艺流程中的吸收剂X。则在此过程中,先后加入的物质分别是 。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因: 。K2FeO4在水溶液中易发生反应:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑,在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH-+3O2↑,在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
a.H2O
b.稀KOH溶液、异丙醇
c.NH4Cl溶液、异丙醇
d.Fe(NO3)3溶液、异丙醇
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)  (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)  NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)  2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
请回答下列问题:
(1)ΔH3与ΔH1、ΔH2之间的关系是:ΔH3=。
(2)反应Ⅲ的化学平衡常数表达式为 。
(3)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①ΔH30(填“>”、“=”或“<”)。
②在T1~T2温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是
。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将
该反应体系温度迅速上升到T2,并维持该温度。已知同浓度的(NH4)2CO3和NH4HCO3溶液
pH前者大,请在下图中画出t1时刻后溶液的pH变化总趋势曲线。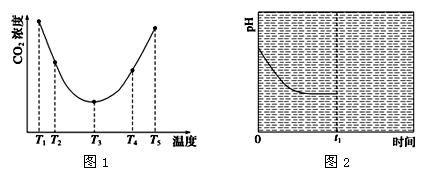
(4)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有。(答出一点即可)
(5)下列物质中也可以作为CO2捕获剂的是。
A.NH4Cl B.Na2CO3C.HOCH2CH2OH
某新型液晶有机物基元IV的合成线路如下: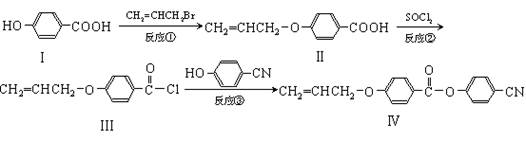
(1)Ⅰ的分子式,Ⅰ中含氧官能团的名称,反应①的类型为。
(2)CH2=CHCH2Br与NaOH水溶液反应的化学方程式。
(3)II可发生加聚反应,所得产物的结构简式。
(4)有关化合物Ⅰ和II的说法中,不正确的是。
| A.1molⅠ充分燃烧需要消耗6mol O2 |
| B.1molⅠ最多可消耗2mol NaOH |
| C.1mol II最多与5mol H2发生加成反应 |
| D.II能使酸性KMnO4溶液褪色 |
(5)一定条件下,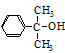 也可与III发生类似反应③的反应,生成有机物V,V的结构简式是。
也可与III发生类似反应③的反应,生成有机物V,V的结构简式是。
(6)化合物I的同分异构体中,苯环上一溴代产物只有两种,遇FeCl3溶液显紫色,还能发
生银镜反应的化合物有多种,写出其中一种同分异构体的结构简式。
[化学—选修5:有机化学基础] (15分)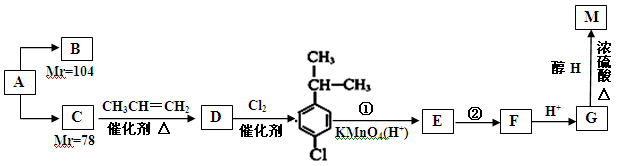
某气态烃A是一种重要的有机化工原料,它对氢气的相对密度为13,以A为原料在不同的反应条件下可以转化为烃B或烃C。B、C的核磁共振谱显示都只有一种氢,B分子中碳碳键的键长有两种。以C为原料通过下列方案可以制备具有广谱高效食品防腐作用的有机物M。(其中Mr为相对分子质量) 
(1)A的结构简式为,C→D的反应类型为。
(2)反应②的化学方程式为。
(3)G中的含氧官能团的名称是,由G反应生成高分子的化学反应方程式为。
(4)B能使溴的四氯化碳溶液褪色,则B的结构简式为,B与等物质的量Br2作用时可能有种产物。
(5)M的同分异构体有多种,写出两种满足以下条件的同分异构体的结构简式:
①能发生银镜反应②苯环有两个取代基,且苯环上一氯取代物只有两种
③遇FeCl3溶液不显色④1mol该有机物与足量的钠反应生成1mol氢气(一个碳原子上同时连接两个—OH的结构不稳定)。、。
[化学——选修3:物质结构与性质] (15分)
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu的第三能层的电子排布式,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为。
(2)PO43-的空间构型是。
(3)氨基乙酸铜的分子结构如图,氮原子的杂化方式为。
(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则CN-中含有的σ键与π键的数目之比为。
(5)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为。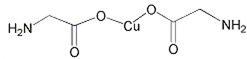
(6)铜晶体为面心立方最密堆积,铜的原子半径为r pm,则晶体铜密度的计算式为g/cm3。
[化学选修——2:化学与技术](15分)
海水是巨大的资源宝库,利用海水提取食盐的过程如图所示。回答下列问题: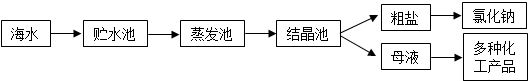
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液。加入试剂的顺序是。
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为,与电源负极相连的电极附近溶液pH的变化是。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱,①则气体B是(填化学式),由NaCl制取纯碱反应的化学方程为、 。
(3)采用空气吹出法从浓海水吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收3mol Br2时,转移的电子数为个。
(4)海水提镁的一段工艺流程如图: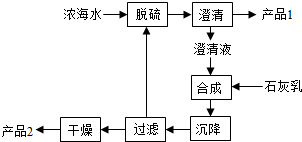
浓海水的主要成分如下:
| 离子 |
Na+ |
Mg2+ |
Cl- |
SO42- |
| 浓度/(g•L-1) |
63.7 |
28.8 |
144.6 |
46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为,1L浓海水最多可得到产品2的物质的量为mol。