25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因 (用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)__ ___0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填>、<、=)
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断
(NH4)2CO3溶液的pH 7 (填>、<、=);
(4)将相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3 | B.NH4A | C.(NH4)2SO4 | D.NH4Cl |
按pH由大到小的顺序排列 (填序号)
有以下一系列反应,终产物为乙二醛。
已知B的相对分子质量比A的大79,请回答:
(1)写出结构简式:A; E。
(2)写出B转化为C的化学方程式_________________
有机物的结构可用“键线式”简化表示
如:CH3-CH=CH-CH3可简写为 。某有机物X的键线式为
。某有机物X的键线式为 。
。
(1)有机物X的分子式为。
(2)X与足量的H2在一定条件下反应可得到有机物Y,则Y分子的一氯取代产物有种。
(3)X的同分异构体Z属于芳香烃,能使溴水褪色,Z的结构简式为,
该芳香烃Z在一定条件下可发生聚合反应,写出其反应的化学方程式。
(4)某醇W与X的相对分子质量相同,1 mol W与足量Na反应能产生标准状况下的氢气22.4 L,经测定W分子有如下特点:①一个碳原子最多连接一个官能团;②该分子不存在官能团位置异构现象。则W的结构简式为。
下表是A、B二种烃的有关信息;
| A |
B |
①能使含溴的四氯化碳溶液褪色;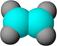 ②比例模型为: ②比例模型为:③能与水在一定条件下反应 |
①由C、H两种元素组成;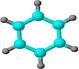 ②球棍模型为: ②球棍模型为: |
根据表中信息回答下列问题:
(1)A与含溴的四氯化碳溶液反应的生成物的名称叫做;
写出在一定条件下,A生成高分子化合物的化学反应方程式_______。
(2) A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=_________时,这类有机物开始出现同分异构体。
(3) B具有的性质是(填序号):
①无色无味液体、②有毒、③不溶于水、④密度比水大、
⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:。
汽油不仅是最重要的燃料,而且是重要的化工原料,它既可以裂解得到气态化工原料如乙烯等,还可以在催化剂催化下改变分子结构,由链烃变成芳香烃,如已烷变成苯,庚烷变成甲苯,这个变化叫异构化。请根据以汽油为原料的下列衍变关系,写出相应的化学方程式及所属反应类型。
(1) ;反应类型;
;反应类型;
(2);
(3);
(4);反应类型。
某烃A与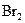 发生加成反应,生成二溴衍生物B;用加热的NaOH乙醇溶液处理B得到化合物C;经测试知C的分子中含有两个双键,分子式为
发生加成反应,生成二溴衍生物B;用加热的NaOH乙醇溶液处理B得到化合物C;经测试知C的分子中含有两个双键,分子式为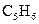 ;将C催化加氢生成环戊烷。试写出A、B、C的结构简式。
;将C催化加氢生成环戊烷。试写出A、B、C的结构简式。
(1)A.___ _____、B.__ ______、C.________。
(2)写出由B得化合物C的反应方程式;该反应的反应类型是反应
(3)已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为:2CH3CH2Br + 2Na → CH3CH2CH2CH3  + 2NaBr应用这一反应,下列所给化合物中可以与钠合成环丁烷的是:
+ 2NaBr应用这一反应,下列所给化合物中可以与钠合成环丁烷的是:
A.CH3Br B.CH3CH2CH2CH2Br C.CH2BrCH2CH2Br D.CH2BrCH2CH2CH2Br