已知I、II反应在一定条件节焓变及平衡常数如下:
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g) S2(g)+4H2O(g)的△H
S2(g)+4H2O(g)的△H
(2)回答下列反应(Ⅰ)的相关问题:
①温度为T1,在1L恒容容器中加入1.8mol H2、1.2mol S2, 10min时反应达到平衡。测得10min V(H2S)=0.08 mol·L-1·min-l,则该条件下的平衡常数为 L·mo1-l,若此时再向容器中充H2、S2、H2S各0.8mol,则平衡移动方向为 (填“正向”、“逆向”或“不移动”);
②温度为T2时T2>T1),在1L恒容容器中也加入1.8mol H2、1.2mol S2,建立平衡时测得S2的转化率为25%,据此判断△H1 0(填“>”或“<”),与T1时相比,平衡常数K1 (填“增大”、“减小”或“不变”);
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是 (写出主要反应的离子方程式),该溶液中,[Na+] 2[ SO ]+ [HSO
]+ [HSO ](填“>”、“<”或“=”)。
](填“>”、“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO 、SO
、SO 物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO
物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO 的水解平衡常数= mol·L-1.
的水解平衡常数= mol·L-1.
(1)KClO3和浓盐酸在一定温度下反应生成黄绿色的易爆物二氧化氯,ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_____倍。
(2)据报载,一家庭主妇在家中打扫卫生时,为了获得更强的去污能力,把洁厕液(用盐酸勾兑成)与漂白粉混合使用,致使发生化学反应产生氯气,导致氯气中毒。试写出工业制漂白粉的化学方程式______________________________________________以及使用时产生氯气的化学方程式:__________________。
某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Al3+、NH4+、Cl-、CO32-和SO42-。现每次取100.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体0.896L(标准状况下)
②第三份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。
请回答:
(1)c(CO32-)=______。
(2)K+是否存在?_____________;若存在,浓度范围是_________________(若不存在,则不必回答第2问)。
(3)根据以上实验,不能判断哪种离子是否存在?若存在,这种离子如何进行检验?
___________________________________________________________________________
(6分)有以下几种物质①干燥的食盐晶体 ②液态氯化氢 ③水银 ④蔗糖 ⑤CO2 ⑥KNO3溶液 ⑦氯气,填空回答(填序号):以上物质中能导电的是;属于电解质的是;属于非电解质的是;
吗啡和海洛因都是严查严禁的毒品,吗啡含C:71.58%,H:6.67%,N:4.91%,其余是氧,已知其分子量不超过300。则吗啡的相对分子量为:;分子式为:
石油资源紧张曾是制约中国发展轿车事业,尤其是制约轿车进入家庭的重要因素。2006年4月, 国家能源领导小组宣布,我国醇醚燃料生成能力已达600多万吨。中国现已推广“车用乙醇汽油”,乙醇完全燃烧生成CO2和H2O。
(1)写出乙醇完全燃烧的化学方程式。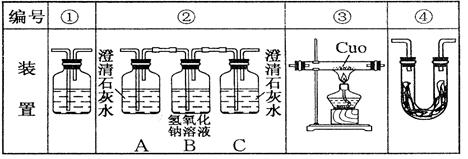
(2)乙醇燃烧时如果氧气不足,可能还有CO生成。用上图装置来确证乙醇燃烧产物CO、CO2、H2O,应将乙醇燃烧产物依次通过,按气流从左至右顺序填装置编号。
(3)实验时可观察到装置②中A瓶的石灰水变浑浊。A瓶溶液的作用是;B瓶溶液的作用是;C瓶溶液的作用是。
(4)装置③的作用是,装置①中所盛的是溶液,作用是。
(5)装置④中所盛的固体药品是,它可以确证的产物是。