从环己烷可制备1,4环己二醇的二醋酸酯,下面是有关的化学反应过程(其中的无机物均已略去)。回答下列有关问题。
(1)反应②的类型是______________,反应⑧的类型是_____________。
(2)反应④的条件、试剂是
(3)写出B、C的结构简式:B________________; C_____________________
(4)写出反应②⑤的化学方程式_________________________________ _________________________________________________________。
反应 A+3B = 2C+3D在四种不同情况下的反应速率分别为:
①v
| A.=0.015 mol (L·s) -1② v | B.=0.06 mol (L·s) -1 ③v |
C.=2.4 mol (L·min ) -1④ v | D.=0.045mol (L·s) -1 |
该反应进行的快慢顺序为
已知下列三个热化学方程式
①H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
③C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131 kJ·mol-1
写出表示碳燃烧生成CO和CO燃烧生成CO2的燃烧热的热化学方程式。
_________________________________________;
_________________________________________。
已知涤纶树脂的结构简式为: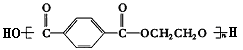 ,它是________和________(填单体的结构简式)通过____________反应而制的,反应的化学方程式为:______________________________________________。
,它是________和________(填单体的结构简式)通过____________反应而制的,反应的化学方程式为:______________________________________________。
下列①—⑩分别代表有关反应中的一种物质,它们均是中学化学中常见物质。已知①—⑤和⑥—⑩分别含有同一种元素:
(1)分别写出①、⑤、⑧的化学式或离子符号:
①;⑤;⑧。
(2)写出下列反应方程式,是离子反应的写出离子方程式:
① + OH-
① + ⑥
下图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH2K2CO3+6H2O
⑴甲池是装置,通入CH3OH的电极名称是,B电极的名称是。
⑵通O2一极的电极反应式为,
⑶乙池中总反应的化学方程式为。
⑷当乙池中A(Fe)极的质量增加6.4g时,甲池中消耗O2mL(标况下)