某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。该小组探究过程如下:
●查阅资料:
| ①镁、铝、锌都是银白色的金属②锌(Zn)可以与NaOH溶液反应生成H2③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+ |
●提出假设:(1)假设①:该混合金属粉末中除镁外还含有________元素假设②:该混合金属粉末中除镁外还含有________元素假设③:该混合金属粉末中除镁外还含有铝、锌元素●实验探究:甲同学基于假设③设计实验方案如下: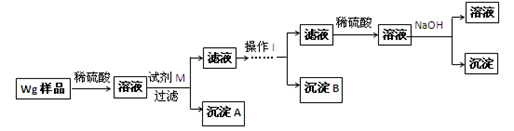
乙同学同样基于假设3设计另一实验方案如下:
(2)试剂M是________________;沉淀B是 。
(3)丙同学认为乙同学的方案比甲同学的好,理由是 。
(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是 。
(5)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是__________。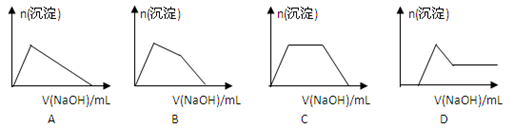
从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下: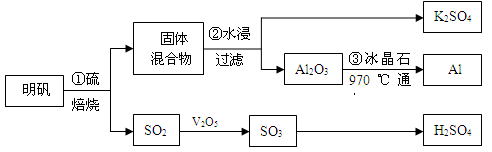
已知:明矾焙烧的化学方程式为:4[KAl(SO4)2·12H2O] + 3S=2K2SO4 + 2Al2O3 + 9SO2↑+ 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化产物与还原产物的物质的量之比为: 。
(2)步骤②中,为提高浸出率,可采取的措施有_____________。
| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
(3)明矾焙烧完全后,从步骤②的滤液中得到K2SO4晶体的方法是 。
(4)步骤③电解的化学方程式是 ,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是: 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)
转化为Ni(OH)2,则该电池的正极电极反应式是 。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为 吨(列出计算表达式)。
(1)已知H-H 键能为436 kJ·mol-1,H-N键键能为391 kJ·mol-1,根据化学方程式: N2(g)+3 H2(g)=2NH3(g) ΔH=-92.4kJ·mol-1。则N≡N键的键能是
(2)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是__________________。
A.C(s) + H2O(g) =" CO(g)" + H2(g) △H > 0
B.2H2(g)+O2(g)=2H2O(1) △H < 0
C.NaOH(aq) + HC1(aq) =" NaC1(aq)" + H2O(1) △H < 0
(3)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式__________。
(4)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中为 a电解液,X和Y均为惰性电极,则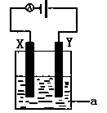
① 若a为CuSO4溶液,则电解时的化学反应方程式为 。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的pH=_______________(假设电解后溶液体积不变)。
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH约为 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
2H2(g)+O2(g)=2H2O(g)ΔH =-483.6 kJ·mol-1
2C(s)+O2(g)=2CO(g)ΔH =-221.0 kJ·mol-1
则C(s)+ H2O(g)=CO(g)+ H2(g)ΔH=____ ___ kJ·mol-1。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
A.Ca(OH)2 B.Na2CO3 C.CaCl2 D.NaHSO3
(3)汽车尾气中有NOx和CO的生成:
①已知气缸中生成NO的反应为:N2 (g)+O2(g)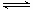 2NO(g)△H
2NO(g)△H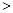 0
0
ⅰ.若1L空气含0.8molN2和0. 2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
ⅱ.恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是
A混合气体的密度不再变化
B混合气体的平均分子量不在变化
C N2 、O2、NO的物质的量之比为1:1:2
D氧气的百分含量不在变化
ⅲ.若升高温度,则平衡___________(填“正向”或“逆向”或“不”下同)移动,逆反应速率 (填“变大 ”或“变小”或“不变”)。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g)。已知该反应的△H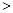 0,则该设想能否实现 (填“能”或“不能”)?
0,则该设想能否实现 (填“能”或“不能”)?
(4)综上所述,你对该市下一步的环境建设提出的建议是
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右。
资料:氰化钠化学式为NaCN,白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味。剧毒,皮肤伤口接触、吸入、吞食微量可中毒死亡。熔点563.7℃,沸点1496℃。易溶于水,易水解生成氰化氢,水溶液呈强碱性,是一种重要的化工原料, 用于电镀、冶金和有机合成医药、农药及金属处理方面。
(1)氰化钠要用双氧水或硫代硫酸钠中和。①用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式 ;
②用硫代硫酸钠中和的离子方程式为CN-+S2O32-=A+SO32-,A为 (填化学式)。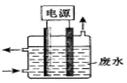
(2)含氰废水中的CN-有剧毒。
①用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,
则:①阳极电极方程式为:
②去除CN-的离子方程式为:
(3)过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,也可用于含氰废水的消毒。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下: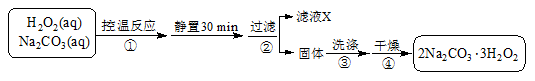
已知:2Na2CO3(aq)+ 3H2O2(aq) 2Na2CO3·3H2O2(s)ΔH < 0,请回答下列问题:
2Na2CO3·3H2O2(s)ΔH < 0,请回答下列问题:
①下列物质中,不会引起过碳酸钠发生氧化还原反应的有 。
| A.FeCl3 | B.CuSO4 | C.Na2SiO3 | D.KCN |
②准确称取0.2000g过碳酸钠于250mL锥形瓶中,加50 mL蒸馏水溶解,再加50 mL2.0 mol·L-1 H2SO4,用0.02000mol·L-1 KMnO4标准溶液滴定,是否需要指示剂 (填“是”或“否”),若终点时消耗KMnO4标准溶液30.00 mL,则产品中H2O2的质量分数为 。
[反应6KMnO4 + 5(2Na2CO3·3H2O2)+19H2SO4 = 3K2SO4 + 6MnSO4 +10Na2SO4 +10CO2 ↑ +15O2↑+34H2O]
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题。
工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)  2SO3(g) + Q
2SO3(g) + Q
某温度下,测得SO2(g)的平衡转化率( )与体系总压强( p )的关系如上图所示。
)与体系总压强( p )的关系如上图所示。
28.a、b两点对应的平衡常数K(a) K(b) (填“>”、 “<”或“=”,下同),SO3浓度c(a) c(b)。c点时,反应速率υ(正) υ(逆)。
将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
||
| SO2 |
O2 |
SO2 |
O2 |
||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
29.实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为 ,温度T1大于T2的理由是 。
30.制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐。
①0.1 mol/L的NaHSO3溶液中c(H+) >c(OH-),用水解和电离理论的角度解释其原因 ,若往溶液中加入氨水至中性,则c(Na+) c(HSO3-)+c(SO32-)+c(H2SO3)(填“>”、 “﹤”或 “=”)。
②往0.1 mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+) :c(SO32-)的比值 (填“变大”、“变小”或“保持不变”)。