选做【化学物质结构与性质】右图a~f分别表示由H、C、N、Na、Si、Cu元素组成的单质,其中c、d均为热和电的良导体。单质分别对应的熔点如图所示: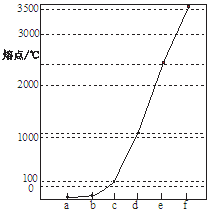
(1) 从电负性角度分析,C、Si和N元素的非金属活泼性由强至弱的顺序为 ;
从电负性角度分析,C、Si和N元素的非金属活泼性由强至弱的顺序为 ;
(2)图中d单质对应元素原子的电子排布式 。用价层电子对互斥理论推断,单质a、b、f对应的元素以原子个数比1:1:1形成的分子中化学键的键角为 。
(3)a与b的元素形成的10电子中性分子X,X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为 。
(4)上述六种元素中的一种元素形成的含氧酸分子的结构模型(原子共平面)如图: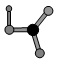
则可判断该元素原子(中心原子)的杂化方式是 。氮化硅是一种高温陶瓷材料,硬度大、熔点高、化学性质稳定,其基本结构单元如图,则其化学式为_______。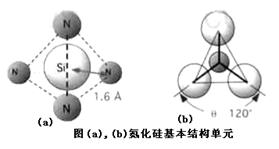
(4分)将00C 101KPa条件下的氯化氢(HCl)气体44.8L,通入492mL水中,(已知水的密度为:1.00g/mL),得到密度为1.13g/mL的盐酸(即氯化氢的水溶液)。[
(1)求此盐酸的质量分数?(计算结果保留一位小数)
(2)求此盐酸的物质的量浓度? (计算结果保留一位小数)
将250mLH2SO4的质量分数为98%,密度为1.84g/cm3的浓硫酸稀释到1000mL。
(1)浓硫酸的物质的量浓度是多少?
(2)此时溶液中H2SO4的物质的量是多少?
(3)稀释后溶液中H+的物质的量浓度是多少?
有CO与CO2的混合气体共33.6 L,其密度为1.7g/L,已知混合气体共有9.03×1023个分子,则该混合气体的平均摩尔质量是多少?CO与CO2的分子个数比是多少?
实验室用氯化钠固体配制1.00 mol/L的NaCl溶液0.5 L,回答下列问题
(1)请写出该实验的实验步骤
①,②,③,④,⑤。
(2)所需仪器为:容量瓶 (规格:)、托盘天平、还需要那些实验仪器才能完成该实验,请写出:。
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因。
①为加速固体溶解,可稍微加热并不断搅拌。在未降至室温时,立即将溶液转移至容量瓶定容。对所配溶液浓度的影响:(填“偏高”“偏低”或“不变”),原因是:。
②定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响,原因是:。
根据混合物的特点,分离方法一般有过滤、蒸发、蒸馏……,欲把碘从碘水中分离出来,可在溶液中加入四氯化碳充分振荡后静置,可观察到现象,能用四氯化碳从碘水中萃取碘的原因是,接着可用方法将两层液体分开,操作时用到的化学仪器叫。四氯化碳萃取碘后,如何分离出碘。