用于金属焊接的某种焊条,其药皮由大理石(CaCO3)、水泥、硅、铁等配制而成。
(1)Al的原子结构示意图为________ ___;
(2)30Si的原子的中子数为_________;
(3)可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(填序号)
除去石灰水中悬浮的大理石颗粒 。
在密闭容器中,通入xmolH2和ymolI2(g),改变下列条件,反应速率将如何改变?(填“增大”、“减小”或“不变”)
(1)升高温度;
(2)加入催化剂;
(3)容器容积充入H2;
(4)扩大容器的体积
(5)容器容积不变,通入氖气
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1) B元素的名称______;B在周期表中的位置第______周期,第________族;
(2) C的元素符号________,C的最高价氧化物的化学式_______;
(3) D的最高价氧化物对应的水化物的化学式____
根据反应:Zn+CuSO4===ZnSO4+Cu,选择适宜的材料和试剂设计一个原电池。
(1)负极材料,电解质溶液是。
(2)写出电极反应式正极;负极。
(3)画出装置图,并标明各部分材料名称。
(3分)有1H216O、D2S、3H218O、S17O2、2H2S、S16O2,其中有种元素,种核素,种分子。
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水。氢气是一种清洁能源,液氢和肼均可用作火箭燃料。
Ⅰ氢气的制取与储存是氢能源利用领域的研究热点。
已知: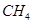 (g)+
(g)+  (g)=
(g)= (g)+
(g)+ (g)
(g)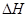 = +
= +
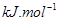
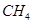 (g)+
(g)+ 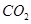 (g)=
(g)= (g)+
(g)+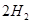 (g)
(g)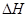 = +
= +
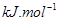
(1)氢气作为新能源的优点。(答2点)
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。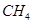 (g)与
(g)与 (g)反应生成
(g)反应生成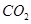 (g)和
(g)和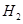 (g)的热化学方程式为。
(g)的热化学方程式为。
(3)H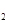 O的热分解也可得到H
O的热分解也可得到H ,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是、。
,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是、。
Ⅱ(4)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,负极的电极反应式是。
(5)下图是一个电化学装置示意图。用肼一空气燃料电池做此装置的电源。
①如果A是铂电极,B是石墨电极,C是硫酸—硫酸铵,阴极的电极反应式是。
②利用该装置可制得少量过氧化氢:在阳极上SO42—被氧化成S2O82—(过二硫酸根离子),S2O82—与H2O反应生成H2O2,S2O82—+2H2O=2SO42—+H2O2+2H+。若要制取2molH2O2,该燃料电池理论上需消耗molN2H4。
(6)由A、B、C、D四种金属按下表中装置进行实验。
①装置丙中溶液的P H。(填“变大”“变小”或“不变”)
②四种金属活泼性由弱到强的顺序是。