某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。
一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出0.224L(标准状况)能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g。
g。
另一份加入含0.001molKMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是_____________和_____________,阴离子是__________________________。
(2)该结晶水合物的化学式_______________________________________。
E是某类化妆品生产的常用添加剂(香料),工业上以Y、X为主要原料合成,其中Y的产量可以用来衡量一个国家石油化工发展水平产品,其流程图如下。请完成填空:
(1) 已知A、B的相对分子质量相差16,则A结构简式为_
(2) 写出反应⑤的化学反应方程式
(3)E(乙酸苯甲酯)有多种同分异构体,其中属于酯类、且为一取代苯结构的有
种(不包括E本身),任写其中一种的结构简式。
(4)除图示方法外,请你另设计一种最佳方案由Y制得A(用类似以上流程图表示)
(5)若将反应③、④的条件做如下变动,将先后得到 、
、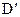 而得不到
而得不到 、
、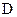 :
:
已知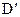 与
与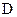 的分子式相同,且
的分子式相同,且 可与
可与 溶液发生显色反应,写出符合条件的由X→
溶液发生显色反应,写出符合条件的由X→ (
( 的一硝基代物有2种)的反应方程式_______。
的一硝基代物有2种)的反应方程式_______。
已知A—K均为短周期元素形成的常见物质,H、I为气体单质,c为一种无色液体,I和K是工业上重要的还原剂,反应②是重要的化工反应原理,且它们有如下的转化关系:
(1)分别写出F、K的化学式: F, k。
(2)写出反应②的离子方程式
(4)反应②的原料F常常从自然界中获得.但其中常含有Ca2+、Mg2+、Fe3+和SO42-等杂质,因此需要精制除去杂质,现设计一套方案如下.请回答:
其中:试剂3为;试剂4作用除;操作Ⅰ的名称为
阅读下表中部分短周期主族元素的相关信息:
| 元素代号 |
相关信息 |
| T |
T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X |
X的原子最外层电子数是其内层电子数的三倍 |
| Y |
在第三周期元素中,Y的简单离子半径最小 |
| Z |
T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
请回答:
(1)元素T与X按原子个数比1:1形成的化合物B属于有晶体。已知在通常条件下,39g B与足量CO2反应放出Q kJ的热量,写出该反应的热化学方程式。
(2)将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴加边振荡),此过程中实验现象。
(3)已知1mol化合物A与Na2SO3在溶液中发生反应时,转移mol电子
(4)在一定条件下,X、Y两种单质以及有孔惰性电极在化合物TZ的水溶液中可形成原电池,为新型海水航标灯提供能源,写出该原电池正极的电极反应式。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42— 、OH- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。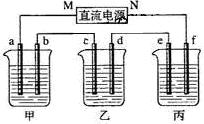
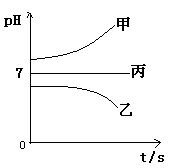
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”)
电极b上发生的电极反应为 ;
(2)计算电极e上生成的气体在标准状态下的体积: ;
(3)写出乙烧杯的电解池反应
(4)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是
[化学—选修有机化学基础] (15分)
中药莲花清瘟胶囊是治疗甲型H1N1流感的有效药物,连翘是其主要成分之一,芳香族化合物X是合成连翘的有效成分连翘酯苷的中间体。
已知:
①X的相对分子质量180,碳的质量分数为60%,氢为4.45%,其余为氧;
②1mol X最多能与3mol NaOH反应,且X能与NaHCO3反应产生CO2气体;
③X遇FeCl3发生显色反应;
④经红外光谱分析X分子中含有碳碳双键。
请回答下列问题:
(1)X的分子式为,X中含有的官能团的结构简式为。
(2)X可发生的反应有。
| A.取代反应 | B.加聚反应 | C.水解反应 | D.银镜反应 E.酯化反应 |
(3)X分子中苯环上两个相同的取代基相邻,与另一种取代基不相邻,核磁共振氢谱表明有8种氢原子,则其结构简式为。
(4)X与足量的浓溴水反应的化学方程式为。
(5)有机物Y与X互为同分异构体,请写出符合下列条件的Y结构简式。
①Y的苯环上有三个互不相邻的取代基,遇FeCl3不发生显色反应,不与NaHCO3反应,但能与Na反应生成H2;
②1mol Y最多能与4mol Ag(NH3)2OH发生银镜反应;
③在一定条件下,1mol Y最多与2mol NaOH反应。