A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;② 、
、 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
HmDm的电子式___________________。
能证明 、
、 的还原性强弱的离子方程式为__________________________________。
的还原性强弱的离子方程式为__________________________________。
(3)将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:__________________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式 。
在该溶液中溶质中含有的化学键类型是
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。
写出下述变化的化学方程式,并标明反应条件和反应类型:
(1)苯→氯苯:化学方程式_______________,反应类型________。
(2)甲苯→三硝基甲苯:化学方程式___________,反应类型__________。
(3)苯→环己烷:化学方程式_________,反应类型__________。
(4)甲苯→间溴甲苯:化学方程式____________,反应类型__________。
(一)以下物质中能导电且属于电解质的是 ,属于非电解质的是
①漂白粉 ②铜 ③氧气 ④BaSO4固体 ⑤稀硫酸 ⑥蔗糖 ⑦CO2 ⑧熔化的KNO3
写出电离方程式:硫酸铝
(二)某化学实验小组需用480mL 0.2mol/L的硫酸铜溶液,请回答下列问题:
(1)如果用胆矾(CuSO4•5H2O)来配制,至少需用胆矾的质量为 g。
(2)在该实验中要用到容量瓶,使用容量瓶前应
(3)下面是配制硫酸铜溶液过程中的5个操作步骤:
①向盛有胆矾的烧杯中加入200ml蒸馏水使其溶解;
②继续往容量瓶中加蒸馏水,至液面距刻度线1-2cm处;
③将烧杯中的溶液沿玻璃棒注入容量瓶中;
④在烧杯中加入少量的蒸馏水,洗涤烧杯内壁和玻璃棒2-3次后移入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀;
⑤改用胶头滴管加水至刻度线,盖好瓶塞,反复上下颠倒,摇匀。
正确的操作顺序为 (填序号)
(4)上述操作⑤中,如果不小心加水超过刻度线,处理方法是
(5)下列操作会导致所配硫酸铜溶液物质的量浓度偏低的是 (填序号)
①在烧杯中搅拌溶液时,有少量液体溅出
②定容摇匀后,发现溶液液面低于刻度线,又滴加蒸馏水至刻度线
③容量瓶洗净后残留少量蒸馏水
④所使用的容量瓶刚用某种浓度的硫酸铜溶液润洗过
⑤定容时仰视刻度线
1923年以前,甲醇一般是用木材或其废料的分解蒸馏来生产的。现在工业上合成甲醇几乎全部采用一氧化碳或二氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)反应②是____________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P的关系如右图所示。则平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”)。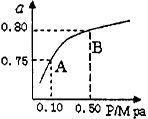
据反应①与②可推导出K1、K2与K3之间的关系,则K3=_________(用K1、K2表示)。
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如右图所示,
若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是。
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是_________________;
氯元素(Cl)是最重要的“成盐元素”,主要以NaCl的形式存在于海水和陆地的盐矿中。食盐不仅是人体必需的物质,而且是重要的化工原料,从海水中提取氯并应用于工农业生产中的图示如下。
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质、精制后可得饱和NaCl溶液。精制时通常在溶液中依次加入的试剂及操作正确的是 ;
A.过量的BaCl2 过量NaOH
过量NaOH 过量Na2CO3
过量Na2CO3 过滤
过滤 过量HCl
过量HCl
B.过量的NaOH 过量Na2CO3
过量Na2CO3 过量BaCl2
过量BaCl2 过滤
过滤 过量HCl
过量HCl
C.过量的BaCl2 过量Na2CO3
过量Na2CO3 过量NaOH
过量NaOH 过滤
过滤 过量HCl
过量HCl
D.过量的NaOH 过量 BaCl2
过量 BaCl2 过量Na2CO3
过量Na2CO3  过量HCl
过量HCl 过滤
过滤
写出加入盐酸后可能发生的化学反应的离子方程式 。
(2)工业上用电解饱和食盐水的方法制取烧碱和氢气、氯气。下图是电解饱和食盐水装置的一部分,请将装置补充完整,并标出阴阳极和通电时溶液中离子移动的方向。
阴极反应式为 ;反应类型 (填氧化或还原反应),
总电极反应式为 。
(3)在实验室中用浓盐酸与MnO2共热可制取Cl2。
①下列收集Cl2的装置正确的是_______________ ;
②检验是否有氯气生成可采用的方法是 ;
A.用干燥的蓝色石蕊试纸 B.用干燥的有色布条
C.用湿润的淀粉碘化钾试纸 D.将气体通入硝酸银溶液
③将制得的Cl2与Ca(OH)2充分反应,可制得漂粉精,写出反应的化学方程式 。
某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向________(填“正”、“逆”)反应方向移动,理由是。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向______(填“正”、“逆”)反应方向移动,溶液中c(A-)将________(填“增大”、“减小”或“不变”),溶液中c(OH-)将________(填“增大”、“减小”或“不变”)。
(3)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_______性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=。