铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。( 提示:位于晶胞不同位置的离子,可被不同数目的晶胞所共用)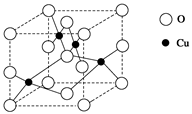
(2)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4 ·H2O,其结构示意图如下: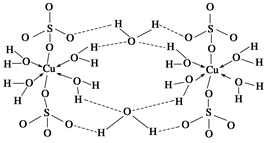
下列说法正确的是 (填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
( 3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是___________________。
3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是___________________。
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,。回答下列问题:
(1)写出一由A与C元素形成的阳离子的结构式___________;A、B、C、E四种元素都能与D元素形成原子个数比1:1化合物, 其中既含离子键,又含非极性共价键的是______________________(写化学式)
(2)A、B、D、E四种元素组成的某无机盐,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式
______________________________________________________________________。
(3)常温下,X、Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+ 浓度之比是_______________________________。
(4)1mol B的固体单质甲转化为1molB的另一种固体单质乙,吸收热量a kJ,已知甲的燃烧热为b kJ/mol,则乙的燃烧热为_______________________。
(5)化学反应:3A2(g)+C2(g) 2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),右图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________。温度为T ℃时,将4a mol A2和2a mol C2放入密闭容器中,充分反应后测得平衡混
2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),右图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________。温度为T ℃时,将4a mol A2和2a mol C2放入密闭容器中,充分反应后测得平衡混 合气中CA3的体积分数为50%,则此时C2的转化率为______________。
合气中CA3的体积分数为50%,则此时C2的转化率为______________。
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为:
CH3—CH2—O—CH2—CH3
其核磁共振谱中给出的峰值(信号)有两个,如图所示:
(1)下列物质中,其核 磁共振氢谱中给出的峰值(信号)只有一个的是(多选扣分)。
磁共振氢谱中给出的峰值(信号)只有一个的是(多选扣分)。
A.CH3CH3B.CH3COOH
C.CH3COOCH3D.CH3OCH3
(2)化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如右图所示,则A的结构简式为:,请预测B的核 磁共振氢谱上有个峰(信号)。
磁共振氢谱上有个峰(信号)。
(3)已知某含C、H、O三种元素的未知物R,经燃烧分析实验测定该未知物碳的质量分数为52.16%,氢的质量分数为13.14%,且R的相对分子质量为46,试求R的分子式__________;用核磁共振氢谱的方法来研究R的结构,简要说明根据核磁共振氢谱的结果来确定R分子结构的方法是 。
。
(14分) (1)键线式 表示的分子式 _____;名称是。
表示的分子式 _____;名称是。
(2) 中含有的官能团的名称为。
中含有的官能团的名称为。
(3)写出符合分子式为C5H12的所有同分异构体的结构简式以及它们的习惯命名:
________________________________________________________________________________________
(4)含有杂质的工业乙醇的蒸馏装置中,玻璃仪器有酒精灯、蒸馏瓶、_________、_________、尾接管、锥形瓶。
(12分)下列有机物化合物中,有多个官能团。
(1)可以看作醇类的是:;(2)可以看作酚类的是;
(3)可以看作羧酸类的是:;(4)可以看作酯类的是:;
(5)可以看作醛类的是:;(6)可以看作醚类的是:。
(9分) 右图所示水槽中试管内有一枚铁钉,放置数天后观察:
(1)铁钉在逐渐生锈,则铁钉的 腐蚀属于腐蚀。(填化学腐蚀或电化学腐蚀)
腐蚀属于腐蚀。(填化学腐蚀或电化学腐蚀)
(2)若试管内液面上升,则原溶液呈性,发生腐蚀,正极反应式为。
(3)若试管内液面下降,则原溶液呈性,发生腐蚀,正极反应式为。