
 已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,其余电子均成对。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,其余电子均成对。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题: (1)X元素在元素周期表中的位置为__________,该元素的符号是__________;
(1)X元素在元素周期表中的位置为__________,该元素的符号是__________; (2)Y元素原子的价层电子的轨道表示式(即价电子排布图)为__ ___ ,该元素的名称是__________。
(2)Y元素原子的价层电子的轨道表示式(即价电子排布图)为__ ___ ,该元素的名称是__________。 (3)X
(3)X 与Z可形成化合物XZ3,该化合物分子为含________键的________分子(填“极性” 或“非极性”)。
与Z可形成化合物XZ3,该化合物分子为含________键的________分子(填“极性” 或“非极性”)。 (4)
(4) 比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明沸点高低的理由。(用化学式表示)
比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明沸点高低的理由。(用化学式表示)
稳定性由强到弱的顺序为____________。沸点由高到低的顺序为______________,
理由是____________。
I下列描述中正确的是()
| A. | 为 形的极性分子 |
| B. | 的空间构型为平面三角形 |
| C. | 中有6对完全相同的成键电子对 |
| D. | 和 的中心原子均为 杂化 |
Ⅱ金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)
原子的核外电子排布式为;
(2)
、
的晶体结构类型均与氯化钠的相同,
和
的离子半径分别为69
和78
,则熔点
(填"<"或">");
(3)
晶胞中
和
的配位数分别为、;
(4)金属镍与镧(
)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为;

(5)丁二酮肟常用于检验
:在稀氨水介质中,丁二酮肟与
反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是 键,碳氮之间的共价键类型是,氮镍之间形成的化学键是;
②该结构中,氧氢之间除共价键外还可存在; ③该结构中,碳原子的杂化轨道类型有。
③该结构中,碳原子的杂化轨道类型有。
有机物
可作为植物生长调节剂,为便于使用,通常将其制成化合物
 ,
在弱酸性条件下会缓慢释放出
。合成
的一种方法及各物质间转化关系如下图所示:
,
在弱酸性条件下会缓慢释放出
。合成
的一种方法及各物质间转化关系如下图所示:
请回答下列问题:
(1)
的名称是_,
与氯气反应可生成
,
的名称是;
(2)经测定
中含有氯元素,且
可以与乙酸发生酯化反应,则
的结构简式为,由
直接生成
的反应类型是;
(3)在弱酸性条件下,
与水反应生成
的化学方程式为;
(4)写出
的两个同分异构体的结构简式。
是自然界存在最广泛的
族元素,常以化合物
存在。从单质A起始发生的一系列化学反应可由下图表示: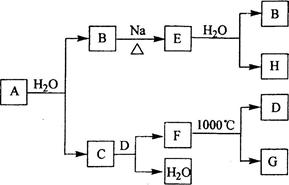
请回答下列问题:
(1)
与水反应的化学方程式为,
与水反应的化学方程式为;
(2)
的化学式为,
和
的电子式分别为;
(3)
与
反应可能生成的盐有(填化学式);
(4)实际生产中,可由
为原料制备单质
,简述一种制备方法。
高炉炼铁过程中发生的主要反应为
已知该反应在不同温度下的平衡 常数如下:
常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式
=,
0(填">"、"<"或"=");
(2)在一个容积为10
的密闭容器中,1000℃时加入
、
、
、
各1.0
,反应经过l0
后达到平衡。求该时间范围内反应的平均反应速率
=、
的平衡转化率=:
(3)欲提高(2)中
的平衡转化率,可采取的措施是。
A.减少 的量
B.增加 的量
C. 移出部分
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
(I已知: ,如果要合成
,如果要合成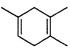 所用的原始原料可以是
所用的原始原料可以是
A. 2-甲基-l,3-丁二烯和2-丁炔 B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔 D、2,3-二甲基-l,3-丁二烯和丙炔
II
都是有机化合物,它们的转化关系如下:
请回答下列问题:
(1)已知:6.0
化合物
完全燃烧生成8.8
和3.6
;
的蒸气与氢气的相对密度为30,则
的分子式为:
(2)
为一取代芳烃,
中含有一个甲基。由
生成
的化学方程式为;
(3)由
生成
、由
生成
的反应条件分别是、;
(4)由
生成
、由
生成
的反应类型分别是、;
(5) 存在于栀子香油中,其结构简式为;
存在于栀子香油中,其结构简式为;
(6)在
的同分异构体中,苯环上一硝化的产物只有一种的共有个,其中核磁共
振氢谱有两组峰,且峰面积比为l:1的是 (填结构简式)。