某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。
请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式: 。
(2)由CO和H2合成甲醇是放热的,方程式是:CO(g)+2H2(g)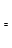 CH3OH(g)。
CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②下图表示合成甲醇反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的甲醇的含量最高的一段时间是 。图中t3时改变的条件可能是 。
(3)某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图: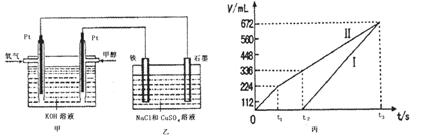
①写出甲中通入甲醇这一极的电极反应式 。
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ,原混合溶液中NaCl的物质的量浓度为 mol/L。(假设溶液体积不变)
(本题共10分)有A、B、C、D、E、F六种元素。
①A、B、C是金属元素,位于同一周期,原子核外都有3个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体。
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体。
请回答:
(1)B位于周期表中第________周期______族,C的原子结构示意图是________。
(2)F单质的化学式是________。
(3)在上述六种元素中,最高价氧化物对应的水化物碱性最强的物质是_____,酸性最强的物质是________,气态氢化物最稳定的是________。
下图中每一个方格表示有关的一种反应物或生成物(部分的产物已省略),X加热产生A、B、C三种物质,其中A、C为无色气体,B在常温下是一种无色的液体,X与NaOH溶液在加热作用下产生一种能使湿润的红色石蕊试纸变蓝的气体C;X与HCl反应产生一种无色无味的气体A,它能使澄清石灰变浑浊,填下列空白:
(1)物质x可以是或,C是,F是。(填写化学式)
(2)B的化学键类型是(填“极性键”或“非极性键”),空间构型是,分子的极性是(填”极性分子”或”非极性分子”)
(3)由C制备D反应的化学方程式
(4)G的浓溶液与木炭反应的化学方程式
有A、B、C、D、E五种短周期元素,已知A、B、C三种元素的原子序数越来越大,在周期表中A、B同族,B、C为同周期相邻元素,这三种元素的原子核外电子数之和是41,D元素的质子数介于A、B之间,它在空气中燃烧生成淡黄色固体,E元素的原子核内中子数比质子数多1个,0.9 g E单质与足量稀盐酸反应生成0.1 g氢气,并转化为E3+,试回答:
(1)写出元素符号A、B、C、D的离子结构示意图、E在周期表中的位置是;C单质的电子式为
(2)用电子式表示B与D形成的化合物的过程:
(3)D在空气中燃烧的化学方程式
(4)写出D、E的最高价氧化物对应水化物间反应的离子方程式:
(1)把下列式子改成氧化物形式
①正长石(KAlSi3O8)
②蛇纹石(H4Mg3Si2O9)
(2)写出下列物质间的关系:红磷与白磷,
35Cl和37Cl
(3)写出除去括号中杂质的方法:
碳酸钠固体(碳酸氢钠晶体)
SiO2固体 (CaO)
CO2 (SO2 )
(4)写出稀硝酸与金属银在加热条件下反应的离子方程式:
将PbO2放入浓盐酸中会产生Cl2,此反应的化学方程式为:
(5)标准状况下,在三个容积相同的干燥的烧瓶中,甲瓶装入干燥纯净的NH3,乙瓶装入含四分之一体积空气的HCl,丙瓶装入NO2和O2(体积比为4:1),以水为溶剂作喷泉实验。实验结束后三个烧瓶中溶液的物质的量浓度之比为,丙瓶中发生反应的总化学方程式为
图Ⅰ是化学实验室中常用制备、干燥气体的部分仪器装置。某学校同学利用中学常用试剂及仪器设计下列实验。
(1)图Ⅰ中仪器B的名称:_______________________。
(2)①同学甲利用图Ⅰ装置制备并收集干燥的NO2气体,请在方框内画出用集气瓶收集NO2的装置图(含尾气处理装置)。②B中发生反应的离子方程式为________________。
(3)同学乙利用图Ⅰ装置通过称量反应前后C的质量,确定Na2CO3和NaCl固体混合物中Na2CO3的质量。A中加入稀硫酸,B中加入Na2CO3和NaCl固体混合物,C中加入碱石灰。该装置存在较多缺陷,从而导致实验误差较大,请你说出其中的两点缺陷:
①______________________________________________________________________;
②______________________________________________________________________。
(4)同学丙利用图Ⅰ装置制取氨气和氧气的混合气体,并且利用图Ⅱ装置验证氨的某些性质。A中加入浓氨水,C中加入碱石灰,E内放置催化剂(铂石棉),按气流方向a→b→c→h连接各仪器。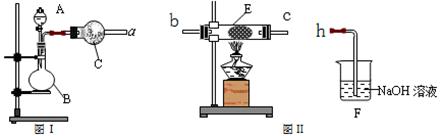
①B内需加入固体试剂的名称为____________________,B中能产生氨气和氧气混合气体的原因是_______________________________________________________________。
②实验中观察到E内有红棕色气体出现,证明氨气具有_________性,E中发生反应的两个化学方程式为:____________________________和2NO + O2 ==2NO2。