以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
 I 从废液中提纯并结晶处FeSO4·7H2O。
I 从废液中提纯并结晶处FeSO4·7H2O。
 II将
II将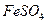 溶液与稍过量的
溶液与稍过量的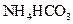 溶液混合,得到含
溶液混合,得到含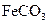 的浊液
的浊液
 IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到
IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到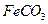 固体
固体
 V煅烧
V煅烧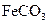 ,得到
,得到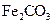 固体
固体
 已知:
已知: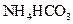 在热水中分解
在热水中分解
(1)  I中,加足量的铁屑出去废液中的
I中,加足量的铁屑出去废液中的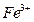 ,该反应的离子方程式是
,该反应的离子方程式是
(2)  II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用
II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用
(3)  III中,生成
III中,生成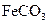 的离子方程式是 。若
的离子方程式是 。若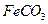 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
(4)  IV中,通过检验
IV中,通过检验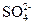 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验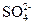 操作是是 。
操作是是 。
(5)  已知煅烧
已知煅烧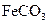 的化学方程式是
的化学方程式是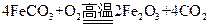 ,现煅烧464.0kg的
,现煅烧464.0kg的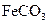 ,得到316.8kg产品,若产品中杂质只有
,得到316.8kg产品,若产品中杂质只有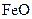 ,则该产品中
,则该产品中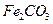 的质量是 kg(摩尔质量/g·
的质量是 kg(摩尔质量/g·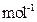 ;
;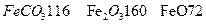 )
)
磷酸铁锂(LiFePO4)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下: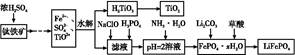
已知:H2TiO3是种难溶于水的物质。
(1)钛铁矿用浓硫酸处理之前,需要粉碎,其目的是 。
(2)TiO2+水解生成H2TiO3的离子方程式为 。
(3)加入NaClO发生反应的离子方程式为 。
(4)在实验中,从溶液中过滤出H2TiO3后,所得滤液浑浊,应如何操作 。
(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁已全部转化为二价铁离子),采取KMnO4标准液滴定Fe2+的方法:(不考虑KMnO4与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果 (填“偏高”、“偏低”或“无影响”),滴定终点的现象是 。滴定分析时,称取a g钛铁矿,处理后,用c mol/L KMnO4标准液滴定,消耗V mL,则铁元素的质量分数的表达式为 。
下表为周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)元素⑥形成的最高价含氧酸根的立体构型是 ,其中心原子的杂化轨道类型是 。
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
| A.分子中含有氢键 |
| B.属于非极性分子 |
| C.含有4个σ键和1个π键 |
| D.该氢化物分子中,②原子采用sp2杂化 |
(4)某元素的特征电子排布式为nsnn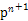 ,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是。
,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是。
(5)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。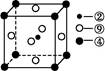
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| X |
578 |
1 817 |
2 745 |
11 578 |
| Y |
738 |
1 451 |
7 733 |
10 540 |
| Z |
496 |
4 562 |
6 912 |
9 543 |
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能的原因是
。
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C三原子都采取sp3杂化。
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示)。
②M是含有 键的 分子(填“极性”或“非极性”)。
③N是一种易液化的气体,请简述其易液化的原因:
。
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 。
⑤AB-中和B2分子的π键数目比为 。
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1。
①E元素组成的单质的晶体堆积模型为 (填字母)。
a.简单立方堆积 b.体心立方堆积
c.六方最密堆积 d.面心立方最密堆积
②F元素在其化合物中最高化合价为 。
③G2+的核外电子排布式为 ,G2+和N分子形成的配离子的结构式为 。
如图所示为血红蛋白和肌红蛋白的活性部分——血红素的结构式。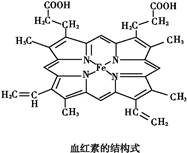
回答下列问题:
(1)血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是 ,写出基态Fe原子的核外电子排布式: 。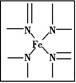
(2)血红素中N原子的杂化方式为 ,在如图的方框内用“→”标出Fe2+的配位键。
(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。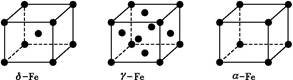
已知X、Y和Z三种元素的原子序数之和等于48。X是有机物主要组成元素。X的一种1∶1型气态氢化物分子中既有σ键又有π键。Z是金属元素,Z的核电荷数小于28,且次外层有2个未成对电子。
(1)X在该氢化物中以 方式杂化。X和Y形成的化合物的熔点应该 (填“高于”或“低于”)X氢化物的熔点。
(2)Y在周期表中位于 ;Z4+的核外电子排布式为 。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看作一种含氧酸盐)。经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。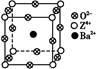
①制备M的化学反应方程式是 (Z用元素符号表示)。
②在M晶体中,Ba2+的氧配位数(Ba2+周围等距且最近的O2-的数目)为 。
③晶体M密度的计算式为ρ= (Z相对原子质量为48)。