三草酸合铁酸钾晶体K3 [Fe(C2O4 )3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草
 酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实
酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实
 验室常用仪器、用品和以下限选试剂完成验证和探究过程。
验室常用仪器、用品和以下限选试剂完成验证和探究过程。
 限选试剂:浓硫酸、1.0 mol·L-1HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1 NaOH、3% H2O2、0.1mol·L-1KI、0.1 mol·L-1CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
限选试剂:浓硫酸、1.0 mol·L-1HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1 NaOH、3% H2O2、0.1mol·L-1KI、0.1 mol·L-1CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
 (1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是 。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是 。
 (2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是 ,现象是 。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是 ,现象是 。
 (3)固体产物中铁元素存在形式的探究。
(3)固体产物中铁元素存在形式的探究。
 ①提出合理假设
①提出合理假设
 假设1: ; 假设2: ;假设3: 。
假设1: ; 假设2: ;假设3: 。
 ②设计实验方案证明你的假设
②设计实验方案证明你的假设
| 实验步骤 |
预期现象与结论 |
| 步骤1: |
|
| 步骤2: |
|
| 步骤3: |
|
| …… |
|





 ③实验过程
③实验过程



 根据②中方案进行实验。按下表的格式写出实验步骤、预期现象与结论。
根据②中方案进行实验。按下表的格式写出实验步骤、预期现象与结论。
某研究性学习小组欲利用所学知识制备并提纯硫酸铜。所用原料为废旧铜材(含铁约2%,其它杂质忽略不计),过程如下:
I:制备硫酸铜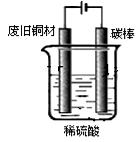
装置如图,写出阳极发生的电极反应式、。
II:提纯硫酸铜
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)
已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
| 离子 |
开始沉淀的pH |
完全沉淀的pH |
| Fe2+ |
6.4 |
8.4 |
| Fe3+ |
2.4 |
3.1 |
| Cu2+ |
5.2 |
6.5 |
(1)写出步骤①发生反应的离子方程式。
(2)步骤②中可加入(填化学式)调节溶液pH至(填范围)。
(3)步骤③不能蒸干的原因是。
(4)下图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是。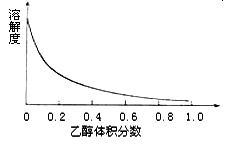
| A.无水乙醇 | B.蒸馏水 |
| C.95%乙醇溶液 | D.饱和硫酸钠溶液 |
(5)操作1的名称是。
碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:
W(s)+ I2(g) WI2(g)ΔH<0
WI2(g)ΔH<0
为模拟上述反应,在450℃时向一体积为2L的恒容密闭容器中加入0.1mol碘单质和足量的钨,2min后反应达到平衡,测得碘蒸气浓度为0.005 mol·L-1。请回答下列问题:
(1)前两分钟内碘蒸气的反应速率为。
(2)能够说明上述反应已经达到平衡状态的有。
| A.I2与WI2的浓度相等 |
| B.容器内气体压强不再变化 |
| C.W的质量不再变化 |
| D.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等 |
E.容器内混合气体的密度保持不变
(3)下图为该反应在450℃时的时间—速率图,则t2时刻改变的外界条件可能是,若t4时刻将容器压缩至一半(各物质状态不变),保持该条件至t6,请在图中画出t4到t6时间段内大致曲线图,并在相应曲线上标上υ3(正)、υ3(逆)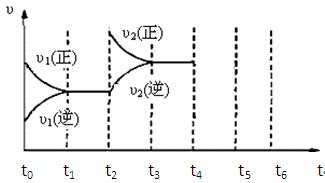
(4)假设灯丝温度为660℃,灯泡壁温度为350℃。请根据化学反应原理分析在灯泡内充入碘能够延长钨丝寿命的原因。
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g) + 2H2(g) CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。
①根据表中数据可判断ΔH0 (填“>”、“=”或“<”)。
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将。
| A.向正方向移动 | B.向逆方向移动 | C.处于平衡状态 | D.无法判断 |
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH=-1451.6 kJ·mol-1
②2CO (g)+ O2(g) = 2CO2(g)ΔH=-566.0 kJ·mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:。
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为,随着反应的不断进行溶液的pH(填“增大”“减小”或“不变”)。
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为mL(标况下)。
CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈性,原因(用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为。
(4)已知Ka(CH3COOH)= 1.76×10-5,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:前者后者(填“>,<或=”)
(5)已知25℃时,0.1mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由。
肉桂酸甲酯( )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
⑴肉桂酸甲酯的分子式是;
⑵有关肉桂酸甲酯的叙述中,正确的是(填标号)
| A.能与溴的四氯化碳溶液发生加成反应 |
| B.无法使酸性高锰酸钾溶液褪色 |
| C.在碱性条件下能发生水解反应 |
| D.不可能发生加聚反应 |
⑶G为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示(图中球与球之间连线表示单键或双键)。
G的结构简式为;
⑷用芳香烃A 为原料合成G的路线如下:

①B→C的反应类型是,
该反应的化学方程式为。
②写出符合下列条件的F的同分异构体的结构简式。
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.一定条件下,1mol该物质与足量银氨溶液充分反应,生成4mol银单质。