有A、B、C、D、E五种原子序数小于18的元素,其特征信息如下:
| 元素编号 |
特征信息 |
| A |
其中一种原子核内只有质子没有中子 |
| B |
其原子的L层电子数是K层的3倍 |
| C |
其阳离子与B的阴离子具有相同的电子层结构, 且核电荷数与B相差3 |
| D |
其原子的最外层电子数等于电子层数,且是地壳 中含量较多的元素之一 |
| E |
单质为黄绿色气体,可用于制造漂白粉 |
请回答以下问题:
(1)由A、B、C三种元素形成的化合物含有的化学键类型是 。
(2)由A、B、C元素中两两组合形成的化合物相互反应生成单质的化学方程
式 。
(3)D单质与由A、B、C三种元素形成的化合物的水溶液反应的离子方程式
。
(4)写出实验室用软锰矿(MnO2)制取E的化学方程式 。
(5)C和D两元素形成的单质活泼些较强的是 (写元素符号),判断依据是 。
有机物F是合成一种新型降压药替米沙坦的中间体,可由下图所示的路线合成: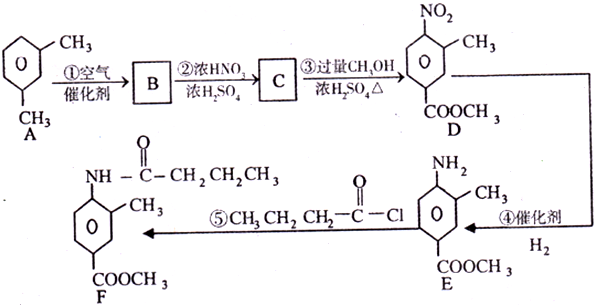
⑴B的结构简式为:__。
(2)反应①~⑤中,属于取代反应的是_; A→B的反应类型_。
(3)C→D的化学方程式为。
浓H2SO4的作用是_;使用过量CH3OH的作用是。
(4)E的同分异构体苯丙氨酸经聚合反应形成的高聚物是_(写结构简式)。
(5)满足下列条件的B的所有同分异构体有种,写出其中苯环上只有一个取代基的结构简式:。
①含苯环;②含酯基;③能与新制氢氧化铜悬浊液反应生成红色沉淀。
(1)CH3+、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们互为等电子体,碳原子均采取sp2杂化 |
| C.CH3-与NH3、H2O+互为等电子体,几何构型均为三角锥形 |
| D.CH3+中的碳原子采取sp2杂化,所有原子均共面 |
E.两个-CH3(甲基)或一个CH3+和一个CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①锌在元素周期表中的位置是:_。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式,葡萄糖分子[CH2OH(CHOH)4CHO]中碳原子杂化方式有。
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于(填“极性分子”或“非极性分子”);在〔Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键。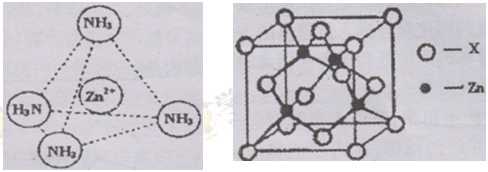
④右上图示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的Zn与X的原子个数之比为。
⑤在④的晶胞(右上图)中,如果只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的___堆积;设该晶胞中Zn的半径为r1 cm,其相对原子质量为M1,X的半径为r2cm,其相对原子质量为M2,则该晶体的密度为_g/cm3 (写出含有字母的表达式)。
镁是“国防金属”,从海水中提取镁通常要经历三大步骤见下图:
请回答下列问题:
(1)步骤1是提高海水中Mg2+浓度,方法是。
(2)步骤2的离子方程式为。
已知Mg(OH)2的Ksp=5.61×10-12,假设浓缩海水中MgCI2浓度为3mo1/L,则要使Mg2+形成Mg( OH )2沉淀,则加入沉淀剂后海水中的OH-浓度至少要达到。
工业生产为了获得更高的利润,根据表1分析,最合理的沉淀剂是_,生产这种沉淀剂的方法是。
表1试剂价格
| 试剂 |
KOH |
NaOH |
Ca(OH)2 |
| 价格(元/吨) |
6800 |
3200 |
1200 |
(3)步骤3如何实现?两位同学设计下列方案: 
这两种方案是否合理?请你评价:
方案一:。
方案二:。
你的设计方案是什么?写出流程图:
。
甲醇是一种很好的燃料,工业上用CH4和H2O 为原料,通过反应I和Ⅱ来制备甲醇。
⑴将1.0 mol CH4和2.0 mol H2O(g)通人反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) CO(g)+3H2(g)……I。CH4的转化率与温度、压强的关系如右图所示。
CO(g)+3H2(g)……I。CH4的转化率与温度、压强的关系如右图所示。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为。
②图中的P1_P2(填“<”、“>”或“=”),100℃时平衡常数为。
③该反应的△H0(填“<”、“>”或“=”)。
(2)在一定条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) CH3OH(g)△H<0……Ⅱ
CH3OH(g)△H<0……Ⅱ
④若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.充人He,使体系总压强增大 D.再充人lmol CO和3 mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.下表中剩余的实验条件数据: a=_;b=_。
| 实验编号 |
T(℃) |
n(CO)/n(H2) |
P(Mpa) |
| 1 |
150 |
1/3 |
0.1 |
| 2 |
a |
1/3 |
5 |
| 3 |
350 |
b |
5 |
B.根据反应Ⅱ的特点,右下图是在压强分别为0.1 MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px = Mpa。
化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3。K为常见固态非金属单质,J、N为常见气态单质,其余为化合物,其中I、F在常温下为液态,C、D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品。F的浓溶液与K加热可生成D和H。(部分生成物未标出)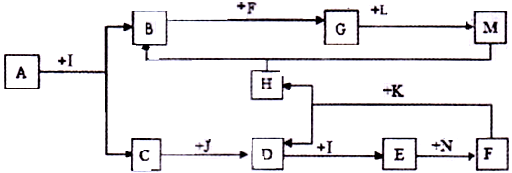
(1)H的结构式为:;B的化学式为:。
(2)写出下列变化的化学方程式:
A+I →B+C:。
F的浓溶液与K加热可生成D和H:。
(3)写出下列变化的离子方程式:
N通入E的水溶液:。
M的水溶液中通人过量的H:。
(4)在A~K所有物质中属于弱电解质的是_,属于非电解质的是(用编号回答)。