(本题共12分)氯化钙是典型的离子型卤化物。完成下列填空:
28.氯原子核外电子排布式为 ,其原子核外能量不同的电子有 种,最外层上有 种不同运动状态的电子,钙元素在元素周期表中位于 。
某研究小组以CaCl2和H2为原料,试图制备+1价Ca的化合物,结果发现产物中只有两种化合物甲和乙。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.29%、46.41%;已知甲与水反应可得H2,乙的水溶液显酸性。
29.该研究小组是否成功制得了+1价Ca的化合物? (填“是”或“否”)。甲的化学式是 。
30.写出甲与水反应得H2的化学方程式 。现欲检验该反应所得溶液中是否含有Cl-,请简述检验的方法 。
31.乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
【化学——物质结构与性质】
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节。
Ⅰ.氢气的制取
(1)水是制取氢气的常见原料,下列说法正确的是 (填序号)。
A.H3O+的空间构型为三角锥形
B.水的沸点比硫化氢高
C.冰晶体中,1 mol水分子可形成4 mol氢键
(2)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图,则其化学式为 。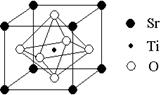
Ⅱ.氢气的存储
(3)Ti(BH4)2是一种储氢材料。
①Ti原子在基态时的核外电子排布式是 。
②Ti(BH4)2可由TiCl4和LiBH4反应制得,TiCl4熔点-25.0℃,沸点136.94℃,常温下是无色液体,则TiCl4晶体类型为 。
(4)最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。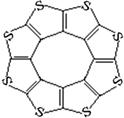
①元素电负性大小关系是:C S(填“>”、“=”或“<”)。
②分子中C原子的杂化轨道类型为 。
③有关键长数据如下:
| C—S |
C=S |
C16S8中碳硫键 |
|
| 键长/pm |
181 |
155 |
176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S与C=S之间,原因可能是: 。
④C16S8与H2微粒间的作用力是 。
【化学——选修2:化学与技术】
海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和 池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用: (写一点即可)。
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通入到阴极室中,理由是 。
②A口排出的是 (填“淡水”或“浓水”)。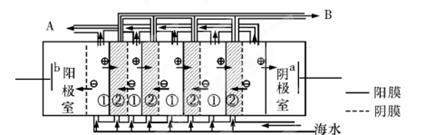
(3)用苦卤(含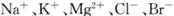 等离子)可提取溴,其生产流程如下:
等离子)可提取溴,其生产流程如下: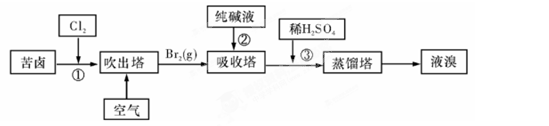
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为: 。
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化重新获得含Br2的溶液? 。
③向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 。
H2O2在工业、农业、医药上都有广泛的用途。
(1)H2O2是二元弱酸,写出第一步的电离方程式 ,第二步的电离平衡常数表达式Ka2= 。
(2)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是 。
①I-②Fe3+③Cu2+④Fe2+
(3)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH- = H2O + HO2-。写出正极反应式: 。
(4)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下:
①第(ⅰ)步,加入H2O2反应的离子方程式 。
②第(ⅱ)步,滤渣中的主要成分在医疗上的用途是 。
③为测定NiSO4·n H2O的组成,进行如下实验:称取2.627g样品,配制成250.00 mL溶液。准确量取配制的溶液25.00 mL,用0.04000 mol·L-1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++ H2Y2-=NiY2-+ 2H+),消耗EDTA标准溶液25.00 mL。则硫酸镍晶体的化学式为 。
【化学—物质结构与性质】氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti原子的电子排布式是________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2  2NH3,实现储氢和输氢。下列说法正确的是________________。
2NH3,实现储氢和输氢。下列说法正确的是________________。
| A.NH3分子中氮原子的轨道杂化方式为sp2杂化 |
| B.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体 |
| C.相同压强时,NH3的沸点比PH3的沸点高 |
| D.[Cu(NH3)4]2+中,N原子是配位原子 |
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是___________。
(4)N2H4中的N原子的杂化类型是__________;N与O第一电离能大小关系是:N___O。
(5)NiO的晶体结构与氯化钠相同,在晶胞中镍离子的配位数是_______。已知晶胞的边长为a nm,NiO的摩尔质量为b g·mol-1,NA为阿伏加德罗常数的值,则NiO晶体的密度为_________g·cm-3。
I.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图: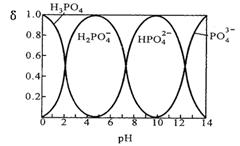
①从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”或“中”),这说明 。
②在Na2HPO4溶液中,c(Na+)/c(HPO42—) 2(填“>”“=”“<”);向该溶液中滴入几滴浓NaOH溶液后,c(Na+)/ c(HPO42—)的值增大,原因是 。
③羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,有关反应为:
5Ca(OH)2+3H3PO4=Ca5(PO4)3OH+9H2O。下图是生产羟基磷灰石时得到的实验曲线,请计算磷酸的初始浓度为0.70mmol/L,pH=9.0条件下,反应前10min内磷酸的沉淀速率 。
II.在某温度下,把4.0mol NH3溶于水中配成1L溶液,测得溶液中OH-浓度和时间的图像如下: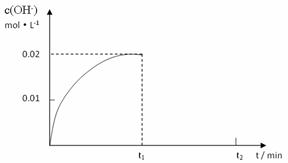
①求该温度时,氨水的电离平衡常数K(写出计算过程,结果保留三位有效数字)
②在t1时刻时再加入H2O配成2L溶液,在t2时刻时重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
③将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)= 。(用含有a、b的式子表示)