下表是元素周期表的一部分.
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的核外电子层中L层电子数比K层电子数多3,则该元素的元素符号是 ,其单质的电子式为 .
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式:
;
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
(4)元素⑤的氢化物是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)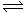 2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
①合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
| A.采用较高压强(20Mpa~50Mpa) |
| B.采用500℃的高温 |
| C.用铁触媒作催化剂 |
| D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2 |
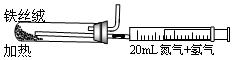
②上图是实验室模拟工业法合成氨的简易装置。简述检验有氨气生成的方法 。
③在298K时,将10 mol N2和30 mol H2放入合成塔中,为何放出的热量小于924kJ?
。
④1998年希腊亚里斯多德大学的Marmellos和Stoukides发明一种合成氨的新方法。在常压下,将H2与用He稀释的N2分别通入一加热到570℃的,以锶-铈-钇-钙钛矿多孔陶瓷(SCY)为固体电解质的电解池中转化为氨气(SCY陶瓷能传递H+),H2转化率达到78%。其实验装置如图所示。阴极的电极反应式 。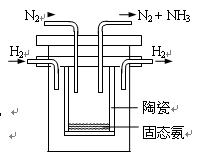
X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4。
请回答:
(1)X的电子式;若实验室用如图所示装置制取X,则制取X的化学反应方程式为。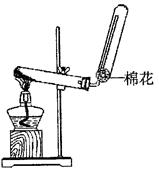
(2)已知:W+X+H2O一白色沉淀,为进一步确定W,
进行如下实验,请补全实验操作、现象和结论:
取上述白色沉淀少量置于试管中,
。
(3)常温下,取10 mL pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化如图所示,则Y的化学式为,下列叙述正确的是(选填字母)。
a.Y的水溶液可用作刻蚀玻璃
b.相同温度时与相同浓度的盐酸比较,Y的水溶液的导电能力弱
c.稀释后,阴离子的物质的量浓度之和增大
(4)分子Z中所含元素对应的单质A及A与B形成的化合物可进行如下转化: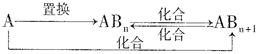
当n=1时,请写出A—ABn的化学方程式(写出一个即可)。
常温下,将某一元酸HA和 NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号[ |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0. 1 1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸___________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等 于0.2________(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________
于0.2________(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________
____________________________
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)=________mol·L-1c(OH-)-c(HA)=________mol·L-1
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程示意图如下所示,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上电极反应为__________________,与电源负极相连的电极附近,溶液pH_________(选填“不变”、“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为_________
_______________________________________________________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂不能是_________。
a. Ba(OH)2 b. Ba(NO3)2c. B aCl2
aCl2
(4)为了有效除去Ca2+、Mg2+、SO42-,加入试剂不合理的顺序为_______(选填a、b、c)
a. 先加 NaOH,后加Na2CO3,再加钡试剂
NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过_________、冷却、_________(填写操作名称)除去NaCl。
有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且 都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级
都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级 电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,C是________,D是________,E是_________。
(2)由 这五种元素组成的一种化合物是(写化学式)________________________。写出该物质的一种
这五种元素组成的一种化合物是(写化学式)________________________。写出该物质的一种
主要用途。______________________________。
(3)写出C元素基态原子的电子排布式_________________________。
(4)用轨道表示式表示D元素原子的价电子构型____________________。
如图为以惰性电极进行电解:
(1)写出B、C、D各电极上的电极反应式和总反应方程式:
A:________________________________,B:________________________________,
总反应方程式:________________________;
C:________________________________, D:________________________________,
总反应方程式:_________ ___________
___________ _______;
_______;
(2)在A、B、C、D各电极上析出生成物的物质的量比为__________________。