某化学兴趣小组为探究的性质,按下图所示装置进行实验。

请到答F列问题:
(1)装置中盛放亚硫酸钠的仪器名称是,其中发生反应的化学方程式为;
(2)实验过程中,装置、中发生的现象分别是,这些现象分别说明具有的性质是 和;装置中发生反应的离子方程式为;
(3)装置的目的是探究与品红作用的可逆性,请写出实验操作及现象;
(4)尾气可采用溶液吸收。
(11分)某化学小组设计实验探究碳酸钠、碳酸氢钠的性质,实验如下:取两支试管分别加入10 mL相同浓度的稀盐酸,将两个各装有0 5 g的Na2CO3和NaHCO3粉末的小气球分别套在两个试管上,将气球内的固体粉末同时倒人试管中,已知盐酸足量,观察实验现象。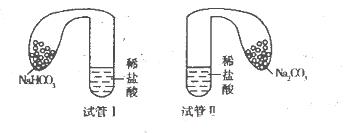
(l)两支试管中均产生气体,其中产生气体较快的为________(填“试管I”或“试管II”),投入________(填化学式)的试管中气球变得比较大。
(2)甲同学触摸上述两试管,发现试管I变冷,试管Ⅱ变热,由此提出不管其状态如何,NaHCO3与HCl反应为吸热反应,Na2CO3与HCl反应为放热反应。
为进一步探究Na2CO3、NaHCO3与盐酸反应的能量变化,乙同学进行下列实验,操作步骤为:①向试剂1中加入试剂2,搅拌、测定温度;②静置、测定温度;③再加入试剂3.搅拌、测定温度、记录。得到以下数据:
上述实验需要用到的玻璃仪器有________。
乙同学可得出结论:
①NaHCO3的溶解过程________(填“吸热”或“放热”,下同);Na2CO3的溶解过程________。
②CO32-与H+反应为一反应(填“放热”或“吸热”,下同),HCO3-与H+反应为________反应。
(3)比较甲乙同学的实验,你认为 ________(填“甲”或“乙”)的实验方案更合理、更严密。
(14分)某研究性学习小组设计实验制各乙酸乙酯(如图1):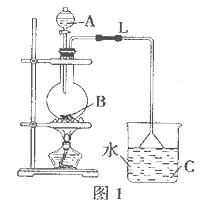
(1)制取乙酸乙酯化学方程式为:____________________.
(2)实验过程中,用酒精灯缓慢加热,“缓慢加热”目的是
(3)烧瓶B中加几块碎石片,其作用是__________。长导管L的作用是
(4)图1方案有明显缺陷,请提出改进建议:____________________.
经改进后,实验现象是______________________________.
简述分离乙酸乙酯的操作方法:___________________,需要用到的下列仪器有__________(填代号)。
(11分)在实验室里用乙醇跟浓H2SO4反应制取乙烯时,常因温度过高而发生副反应,部分乙醇跟浓H2SO4反应生成SO2,CO2,水蒸气和炭黑。
(1)用编号为①→④ 的实验装置设计一个实验,以验证上述反应混合气体中含CO2,SO2和水蒸气。用装置的连接顺序(按产物气流从左到右的流向):
→ → → →。
(2)实验的装置①中A瓶的现象是________;结论为______________。
B瓶中的现象是________;B瓶溶液作用为________;
是否能将B瓶溶液换成酸性高锰酸钾______ (答是,否)。
(3)装置③中加的固体药品是________装置②中盛的溶液是________。
(4)装置④生成乙烯的反应类型是______;若要验证混合气体中有乙烯,应将混合气体先通过盛____________的洗气瓶,再通过盛______的试管中。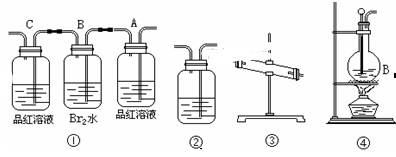
(19分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: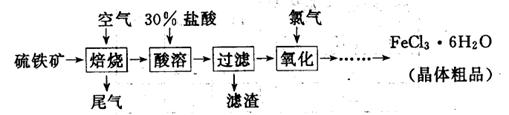
(1)氧化过程中发生反应的离子方程式是,检验氧化生成的阳离子的试剂是。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。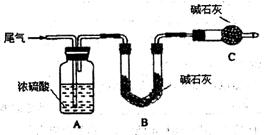
①C仪器的名称是,该装置的作用是。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理,请说明理由(若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是。
②进行沉淀洗涤的方法是。
③SO2含量的表达式是(用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3 6H2O晶体的操作包括、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
6H2O晶体的操作包括、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为: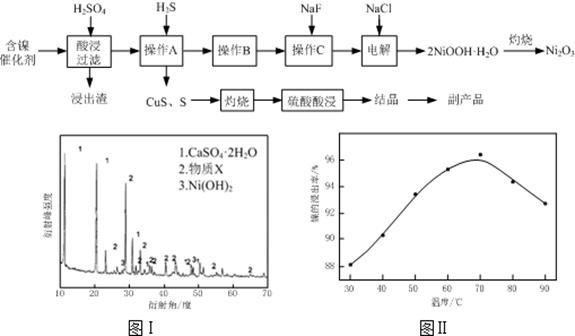
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含 量增大,其原因是。
(2)工艺流程中“副产品”的化学式为。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
7.7 |
| 沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价
(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则Ca2+的浓度为mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。
第②步反应的离子方程式为。