(15分) Ⅰ、某同学用下图所示装置(尾气吸收装置未画出)向溶液Y中通入NH3和CO2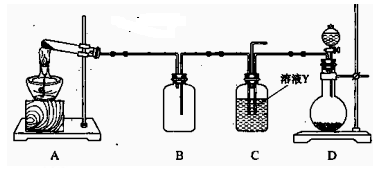
(1)下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH e.浓氨水
f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 (用药品序号填
空,下同);装置D处固体药品的最佳选择为 (用药品序号填空)。
(2)下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
| A.MnO2与浓盐酸反应制备Cl2 | B.Cu与浓硫酸反应生成SO2 |
| C.由H2O2分解制O2 | D.乙醇与乙酸反应制备乙酸乙酯 |
E.Zn与稀硫酸反应制备H2
(3)写出上述装置A处的试管中所发生反应的化学方程式:
。
Ⅱ、甲同学利用下图所示装置探究SO2和Cl2两种气体按不同比例混合后的漂白性。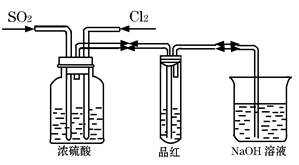
试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:
。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: (结合反应方程式)。
下图是配制50 mL KMnO4标准溶液的过程示意图。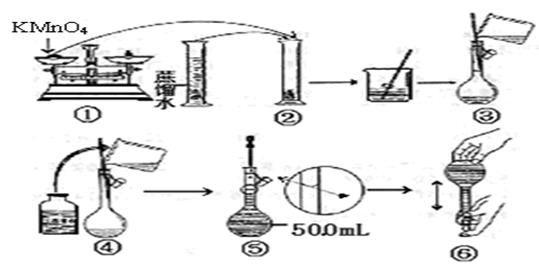
(1)请你观察图示判断其中不正确的操作有(填序号)____________;
(2)其中确定50mL溶液体积的容器是(填名称)__________________;
(3)如果用上述操作所配制的KMnO4溶液与未知浓度的草酸溶液进行实验,2KMnO4+ 5H2C2O4 + 3H2SO4= 2MnSO4 + 10CO2 + 8H2O,在其他操作均正确的情况下,所测得草酸溶液的浓度将____________(填偏大或偏小)。
实验室用固体烧碱配制500 mL 0.1 mol·L―1的NaOH溶液。
(1)需称量____________g的烧碱固体,它应该盛放在____________ 中进行称量。
(2)配制过程中,不需要使用的仪器是(填写代号)_________________。
A.烧杯 B.量筒 C.1000 mL容量瓶 D.托盘天平E.药匙 F.500 mL容量瓶 G.胶头滴管 H.漏斗
除上述可使用的仪器,还缺少的仪器是_________ ,
(4)叙述定容过程中的操作___________________________________。
(5)要配制浓度约为2 mol·L-1 NaOH溶液100 mL,下列操作正确的是_____ 。
①称取8 g NaOH固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解。
②称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL。
③称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水至刻度线,塞好瓶塞,反复摇匀。
④用100 mL量筒量取40 mL 5 mol·L-1 NaOH,倒入250 mL烧杯中,再用同一量筒量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中。
(6)下列操作导致所配溶液浓度偏高的是
A.称量时,左盘高,右盘低 B.定容时俯视容量瓶刻度线
C.原容量瓶洗净后没有干燥D.摇匀后见液面下降,再加水至刻度线
(每小题2分,共14分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250mL的容量瓶中定容成250mL烧碱溶液; |
| B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂; |
| C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为Mmol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始时的刻度数为V1mL; |
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点时消耗酸的体积为V2mL。
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写)
________→________→________→____D____→________;
(2)滴定管读数应注意 ___________________。
(3)操作E中在锥形瓶下垫一张白纸的作用是 _________________。
(4)操作D中液面应调整到 ,尖嘴部分应 。
(5)滴定终点时锥形瓶内溶液的pH约为 ,终点时溶液颜色的变化是 。
(6)若酸式滴定管没有用标准H2SO溶液润洗,会对测定结果有何影响? (填“偏高”、“偏低”或“无影响”)(其他操作均正确)。
(7)该烧碱样品的纯度计算式是 。
(10分,每空2分)影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L)。设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积的2 mol/L的硫酸于试管中 ②__________ |
反应速率Mg>Fe,Cu不反应 |
金属的性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为____________________
(2)甲同学的实验目的是:在相同的温度下,__________________________________。
实验二:乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。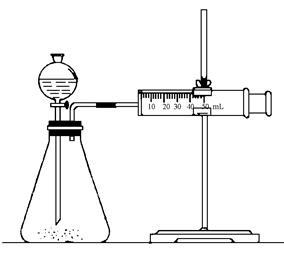
(3)乙同学在实验中应该测定的数据是 。
(4)乙同学完成该实验应选用的实验药品是______________________;该实验中不选用某浓度的硫酸,理由是 。
已知某“84消毒液”瓶体部分标签如右所示,该“84消毒液”通常稀释到100倍(体积之比)后使用。请回答下列问题: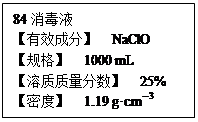
I(1)该“84消毒液”的物质的量浓度约为__________mol·L-1(小数点后保留一位)。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)为__________ mol·L-1。
II某同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。实验步骤如下:
① 将烧杯中的溶液转移至容量瓶中;
② 计算并称量所需的NaClO固体;
③ 向容量瓶中加蒸馏水至液面与刻度线相平;
④ 将NaClO加入100mL 烧杯中,并加适量水溶解;
⑤ 洗涤烧杯和玻璃棒2次,洗涤后溶液转移至容量瓶中;
⑥ 振荡摇匀;
⑦ 颠倒摇匀。
(1)完成上述实验,下图所示的仪器中,还需要添加的玻璃仪器是 。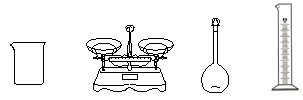
(2)步骤②中计算所需要NaClO的质量为 g;
(3)实验的先后顺序应为 (填写序号);
(4)在步骤①中,为防止溶液溅出,应采取的措施是 ;
(5)在进行步骤③的实验操作时应注意的问题是 ;
(6)配制溶液时,下列实验操作会使配制溶液浓度偏高的是 。
| A.容量瓶内有水,未经过干燥处理 |
| B.进行步骤③操作时,俯视刻度线 |
| C.缺少步骤⑤ |
| D.定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线 |
E.缺少步骤⑥