实验室用固体烧碱配制500 mL 0.1 mol·L―1的NaOH溶液。
(1)需称量____________g的烧碱固体,它应该盛放在____________ 中进行称量。
(2)配制过程中,不需要使用的仪器是(填写代号)_________________。
A.烧杯 B.量筒 C.1000 mL容量瓶 D.托盘天平E.药匙 F.500 mL容量瓶 G.胶头滴管 H.漏斗
除上述可使用的仪器,还缺少的仪器是_________ ,
(4)叙述定容过程中的操作___________________________________。
(5)要配制浓度约为2 mol·L-1 NaOH溶液100 mL,下列操作正确的是_____ 。
①称取8 g NaOH固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解。
②称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL。
③称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水至刻度线,塞好瓶塞,反复摇匀。
④用100 mL量筒量取40 mL 5 mol·L-1 NaOH,倒入250 mL烧杯中,再用同一量筒量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中。
(6)下列操作导致所配溶液浓度偏高的是
A.称量时,左盘高,右盘低 B.定容时俯视容量瓶刻度线
C.原容量瓶洗净后没有干燥 D.摇匀后见液面下降,再加水至刻度线
黄铁矿在高温时和氧气反应生成氧化铁和二氧化硫(假设矿石中的杂质不参与化学反应)。某化学学习小组对黄铁矿样品进行如下实验探究:
【实验一】测定硫元素的含量
I.实验装置如下图所示(夹持和加热装置省略)。A中的试剂是双氧水,将m1g该黄铁矿样品放入硬质玻璃管D中。从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管中的黄铁矿样品至反应完全。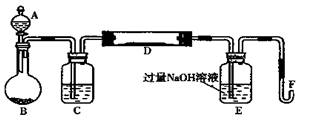
II.反应结束后,将E瓶中的溶液进行如下处理:
【实验二】测定铁元素的含量
III.测定铁元素含量的实验步骤如下:
① 用足量稀硫酸溶解硬质玻璃管D中的固体残渣;
② 加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③ 将滤液稀释至250 ml;
④ 每次取稀释液25.00 ml,用已知物质的量浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V ml。
请回答下列问题:
(1)仪器B中发生反应的化学方程式是;仪器C中装入的试剂是。E瓶的作用是。
(2)II中加入H2O2发生反应的离子方程式。
(3)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还必须要有;④中取稀释液25.00 ml需用的仪器是。
(4)假设在整个实验过程中硫元素和铁元素没有损失,则该黄铁矿样品中硫元素的质量分数为。(用含m1和m2的代数式表示);该黄铁矿中铁元素的质量分数为。(用含m1、c、V的代数式表示)
为了证明稀硝酸与铜反应的气体产物是NO,某同学设计了如下实验装置和实验方案。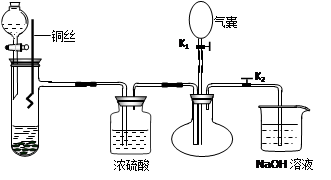
实验步骤:
⑴关闭K1,打开K2,向试管中加石灰石,通过分液漏斗向其中加入一定的稀硝酸,则加入石灰石的作用是______________________________________________________,
反应化学方程式是。
⑵将将铜丝插入稀硝酸中,微热大试管。
该步反应离子方程式是。
⑶充分反应后,打开开关K1,通过气囊鼓入空气,可以观察到烧瓶中,证明稀硝酸与铜反应的气体产物是NO。
⑷NaOH溶液的作用。
某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】① Mg2+检验方法:取2滴待检液,加入2滴2 mol·L-1 NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH会妨碍Mg2+检出。
② Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵。
③很多合金是金属互化物,有确定的化学组成。
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式。
【实验探究】
(1)甲同学设计实验方案,确定焰火原料中的金属种类,实验记录如下。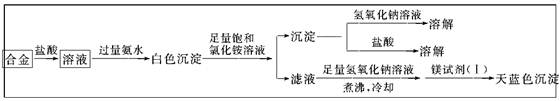
由甲的实验记录可知,该焰火原料是由________和________两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸,煮沸的理由是 。
(2)乙同学利用甲同学的结论,设计如下图所示的实验步骤,确定合金组成。
问题讨论:
①能确定合金组成的数据组有________。(填字母)
A. m、n B. m、y C. n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7 mol,试在下图中作出y随x变化的曲线。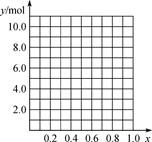
③当y=8.5 mol时,该合金是一种金属互化物,其化学式为________________。
50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: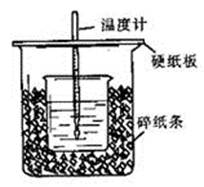
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___________________________。
(2)25℃,101kPa时,1mol稀硫酸与氢氧化钠稀溶液完全反应生成液态水放出114.6kJ的热量,表示该反应中和热的热化学方程式为________________________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________________(填“偏大”、“偏小”、“无影响”)。
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”、“不相等”),所求中和热_________(填“相等”、“不相等”),简述理由___________________ _________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会___________________________;用50 mL 0.50 mol/L NaOH溶液进行上述实验,测得的中和热的数值会____________ ______。(均填“偏大”、“偏小”、“无影响”)
某研究小组在查阅资料中发现,常温下氯气可以氧化氨气获得氮气。该小组由此设计出制取氮气的思路,设计装置图如下。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置A中的烧瓶内固体不可以选用_________(填序号)。
A.生石灰 B.碱石灰 C.五氧化二磷 D.烧碱
(2)装置F发生反应的离子方程式是_____________________________________。
(3)B装置的作用___________________;E装置的作用_______________________。
(4)写出制取N2的化学方程式____________________________;反应生成0.5mol N2,转移的电子是_________mol。