黄铁矿在高温时和氧气反应生成氧化铁和二氧化硫(假设矿石中的杂质不参与化学反应)。某化学学习小组对黄铁矿样品进行如下实验探究:
【实验一】测定硫元素的含量
I.实验装置如下图所示(夹持和加热装置省略)。A中的试剂是双氧水,将m1g该黄铁矿样品放入硬质玻璃管D中。从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管中的黄铁矿样品至反应完全。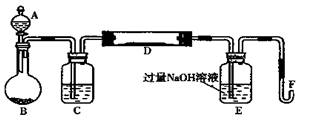
II.反应结束后,将E瓶中的溶液进行如下处理:
【实验二】测定铁元素的含量
III.测定铁元素含量的实验步骤如下:
① 用足量稀硫酸溶解硬质玻璃管D中的固体残渣;
② 加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③ 将滤液稀释至250 ml;
④ 每次取稀释液25.00 ml,用已知物质的量浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V ml。
请回答下列问题:
(1)仪器B中发生反应的化学方程式是;仪器C中装入的试剂是。E瓶的作用是。
(2)II中加入H2O2发生反应的离子方程式。
(3)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还必须要有;④中取稀释液25.00 ml需用的仪器是。
(4)假设在整个实验过程中硫元素和铁元素没有损失,则该黄铁矿样品中硫元素的质量分数为。(用含m1和m2的代数式表示);该黄铁矿中铁元素的质量分数为。(用含m1、c、V的代数式表示)
B.制备水杨酸对正辛基苯基酯( )如下:
)如下:
步骤一:将水杨酸晶体投入三颈烧瓶中,再加入氯苯,搅拌溶解后,加入无水三氯化铝。
步骤二:按图所示装置装配好仪器,水浴加热控制温度在20~40℃之间,在搅拌下滴加SOCl2,反应制得水杨酰氯。
该反应为: (水杨酸)+SOCl2—→
(水杨酸)+SOCl2—→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑
步骤三:将三颈烧瓶中的混合液升温至80℃,再加入对正辛苯酚[ ],温度控制在100℃左右,不断搅拌。
],温度控制在100℃左右,不断搅拌。
步骤四:过滤、蒸馏、减压过滤;酒精洗涤、干燥。
(1)步骤一中加入三氯化铝的作用是 。
(2)实验时,冷凝管中的水应从 进 出(选填“a”或“b”);装置c的作用是 。
(3)步骤三中发生反应的化学方程式为 。
(4)步骤四减压过滤操作中,除烧杯、玻璃棒外,还必须使用的硅酸盐材料的仪器有 。
(5)步骤四减压过滤时,有时滤纸会穿孔,避免滤纸穿孔的措施是 。
目前正在研究和已经使用的储氢合金有镁系合金、稀土系合金等。
(1)已知:Mg(s)+H2(g)=MgH2(s)△H1=-74.5 kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2 =-64.4 kJ·mol-1
Mg2Ni(s)+2MgH2(s)=2Mg(s)+ Mg2NiH4(s)△H3,则△H3 = kJ·mol-1。
(2)工业上用电解熔融的无水氯化镁获得镁。其中氯化镁晶体脱水是关键工艺之一,一种氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4C1·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 。
(3)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑。生成2.7gAl时,产生的H2在标准状况下的体积为 L。
(4)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①下图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由下图可知,下列说法正确的是 (填字母)。
a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②下图为25℃和75℃时,Al-LiBH4复合材料[w (LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。
从图中可知,25℃时Al-LiBH4复合材料中与水完全反应的物质是 (填化学式)。
(5)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
①某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K= 。
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物)。生成目标产物的电极反应式为 。
(15分)利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O]。
I.实验室制取无色的无水AlBr3(熔点:97.5℃,沸点:263.3~265℃)可用如图所示装置,主要实验步骤如下:
步骤l:将铝箔剪碎,用CCl4浸泡片刻,干燥,然后投入到烧瓶6中。
步骤2:从导管口7导入氮气,同时打开导管口l和4放空,一段时间后关闭导管口7和1;导管口4接装有P2O5的干燥管。
步骤3:从滴液漏斗滴入一定量的液溴于烧瓶6中,并保证烧瓶6中铝过剩。
步骤4:加热烧瓶6,回流一定时间。
步骤5:将氮气的流动方向改为从导管口4到导管口l。将装有P2O5的干燥管与导管口1连接,将烧瓶6加热至270℃左右,使溴化铝蒸馏进入收集器2。
步骤6:蒸馏完毕时,在继续通入氮气的情况下,将收集器2从3处拆下,并立即封闭3处。
(1)步骤l中,铝箔用CCl4浸泡的目的是 。
(2)步骤2操作中,通氮气的目的是 。
(3)步骤3中,该实验要保证烧瓶中铝箔过剩,其目的是 。
(4)步骤4依据何种现象判断可以停止回流操作 。
(5)步骤5需打开导管口l和4,并从4通入N2的目的是 。
II.某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示。
实验中可选用的试剂:①处理过的铝箔;②2.0 mol•L-1硫酸;③2.0mol•L-1NaOH溶液。
(6)由铝箔制备硫酸铝晶体的实验步骤依次为:
①称取一定质量的铝箔于烧杯中,分次加入2.0 mol•L-1NaOH溶液,加热至不再产生气泡为止。
②过滤。
③ 。
④过滤、洗涤。
⑤ 。
⑥蒸发浓缩。
⑦冷却结晶。
⑧过滤、洗涤、干燥。
有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂。一种由废催化剂制取PdCl2的工艺流程如下:
(1)“焙烧1”的目的是 。
(2)写出甲酸[HCOOH]与PdO反应的化学方程式 。
(3)在“调pH为8—9”是为除去铁元素,滤渣成分为 ;写出除铁的离子方程式为 。
(4)加入浓盐酸酸洗的目的是 。
(5)写出证明“焙烧2”中固体已分解完全的实验操作: 。
B.[实验化学]铝镁加(Almagate)是一种制酸药,其组成为Al2Mg6(OH)14(CO3)2·4H2O,实验室可通过下列实验制备铝镁加。
步骤1.称取63.5gMgSO4·7H2O(0.26mol),30.5gAl2(SO4)3·18H2O(0.046mol) 溶于400mL水中得到混合溶液A,另称取无水Na2CO352g溶于400mL水得到溶液B。
步骤2.将A、B两溶液同时等速滴加到盛有400mL90℃水的2L三颈烧瓶中,维持90℃,不断搅拌。
步骤3.抽滤,并用蒸馏水洗涤沉淀3~4次,100℃下干燥5h,得白色疏松固体24.3g。
(1)步骤2需缓慢滴加两种溶液并不断搅拌,其主要原因是 。
(2)①步骤3抽滤时用到的硅酸盐质仪器有 、 。
②如何证明沉淀已洗涤干净 。
(3)本次实验所得产品产率为 。
(4)铝镁加中和胃酸的离子方程式为 。