目前正在研究和已经使用的储氢合金有镁系合金、稀土系合金等。
(1)已知:Mg(s)+H2(g)=MgH2(s) △H1=-74.5 kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2 =-64.4 kJ·mol-1
Mg2Ni(s)+2MgH2(s)=2Mg(s)+ Mg2NiH4(s) △H3,则△H3 = kJ·mol-1。
(2)工业上用电解熔融的无水氯化镁获得镁。其中氯化镁晶体脱水是关键工艺之一,一种氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4C1·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 。
(3)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑。生成2.7gAl时,产生的H2在标准状况下的体积为 L。
(4)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①下图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由下图可知,下列说法正确的是 (填字母)。

a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②下图为25℃和75℃时,Al-LiBH4复合材料[w (LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。

从图中可知,25℃时Al-LiBH4复合材料中与水完全反应的物质是 (填化学式)。
(5)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:

①某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K= 。
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物)。生成目标产物的电极反应式为 。

(1)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?
简要说明你的理由:。
(2)该同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用下列装置进行实验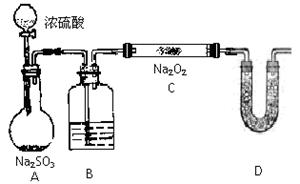
装置中B中的试剂为,其作用是
D中的药品为,其作用是
(3)为确认SO2和Na2O2反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号)
| A.用带火星的细朩条靠近U形管口,观察细朩条是否着火燃烧 |
| B.将C装置中反应后的固体物质溶于适量水配成溶液 |
| C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成 |
| D.在配成的溶液中先加入盐酸酸化,再加入氯化钡溶液,观察是否有气泡或沉淀生成 |
(14分)下表是元素周期表的一部分,请回答有关问题:
| 主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
① |
② |
③ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
||||
| 4 |
⑨ |
④ |
⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为。
(2)表中能形成两性氢氧化物的元素是(用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式
(3)④元素与⑦元素形成化合物的电子式
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是
(填化学式)。
(5)③元素与⑩元素两者核电荷数之差是。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
| 实验步骤 |
实验现象与结论 |
(9分)某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C……)中选出与方案(I)(填1、2、3……)对应的实验现象,填入答案(Ⅲ)中。
| 实验方案(I) |
实验现象(Ⅱ) |
答案(III) |
|
| 实验方案I |
实验现象II |
||
| 1.用砂纸擦后的镁带与沸 水反应,再向反应液中滴 加酚酞 |
A浮与水面,剧烈反应,放出气体, 熔成—个小球,在水面上无定向移 动,随之消失,溶液变红色。 |
1 |
|
| 2.向新制的H2S饱和溶 液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃 烧,溶液变成浅红色 |
2 |
|
| 3.钠与滴有酚酞的冷水反应 |
C.反应不十分剧烈,产生的气体 可以在空气中燃烧 |
3 |
|
| 4.镁带与2mol/L的盐酸 反应 |
D.剧烈反应,产生的气体可以在 空气中燃烧 |
4 |
|
| 5铝条与2mol/L的盐酸 反应 |
E.生成白色絮状沉淀,继而沉淀 消失 |
5 |
|
6.向AlCl3溶液中滴加 溶液至过量 溶液至过量 |
F.生成淡黄色沉淀 |
6 |
(2)通过以上实验分析了同周期元素的符号,从实验结果可以得出的结论是。
火柴是人们常用的生活用品,某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S等物质,设计了以下系列实验,并回答下列各题。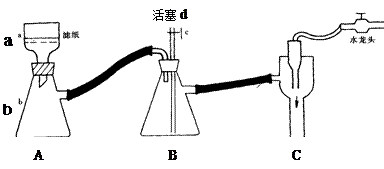
Ⅰ、火柴头中硫元素的实验证明
A B
⑴设计装置A中可观察到 的实验现象,即可证明火柴头上含有S元素。
⑵甲同学认为B装置中除了可选用稀高锰酸钾外还可选用:品红溶液、紫色石蕊溶液、滴有酚酞的NaOH溶液、溴水等,经大家分析后淘汰了紫色石蕊溶液和滴有酚酞的NaOH溶液。你认为淘汰的原因可能是 。甲同学还认为在A装置中选用浓的高锰酸钾酸性溶液更好,因为浓度越大反应速率越快,你认为对吗? (先判断再说明原因)。
Ⅱ、火柴头中含有Cl元素的证明,设计了以下实验流程图: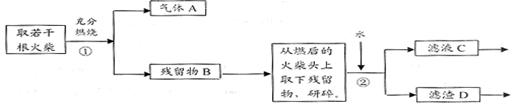
⑴为验证火柴头中含有Cl元素的实验步骤是:取滤液C……请回答后续实验步骤是 。
⑵有学生提出检验火柴头上KClO3另一套实验方案:
|
|
实验中发生的反应是 KClO3 + 3NaNO2 + AgNO3 = AgCl↓+ 3NaNO3 + KNO3,其中NaNO2 是 。剂,有人提出上述方法中出现白色沉淀并不能充分说明火柴头上 KClO3的存在,其理由是 。
Ⅲ、测定火柴头中KClO3的含量,设计了以下实验流程图:
已知:向一体积为2L的密闭容器中加入0.1mol碘单质和足量的钨,当温度为943K时存在:W(s)+I2(g)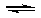 WI2(g)反应,反应达到平衡时碘单质的转化率为20%,
WI2(g)反应,反应达到平衡时碘单质的转化率为20%,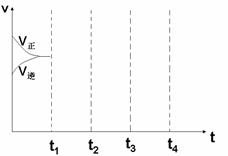
(1)求943K时此反应的平衡常数:K=_____________
(2)若起始时向此密闭容器中再加入0.1mol WI2达平衡,此时容器中各气体的体积比:___________,当同时加入等物质的量I2(g)和WI2(g),平衡___________方向移动(填正反应、逆反应或不移动)
⑶画出W(s) + I2(g) 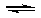 WI2(g) △H<0时间—速率图。一定温度过量W反应达平衡,到t1时降低温度,到t2时再加压,再到t3时加催化剂,到t4时加I2
WI2(g) △H<0时间—速率图。一定温度过量W反应达平衡,到t1时降低温度,到t2时再加压,再到t3时加催化剂,到t4时加I2
(4)一定温度下,向一容积不变的容器中加入足量钨和1molI2(g),使之反应: W(s) + I2(g) 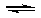 WI2(g) ΔH= —40.9KJ/mol,反应达平衡时气体平均摩尔质量增加 91.9g/mol,反应达平衡时放出的热量(已知钨的相对原子质量为183.8): ____________________.
WI2(g) ΔH= —40.9KJ/mol,反应达平衡时气体平均摩尔质量增加 91.9g/mol,反应达平衡时放出的热量(已知钨的相对原子质量为183.8): ____________________.