(1)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?
简要说明你的理由: 。
(2)该同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用下列装置进行实验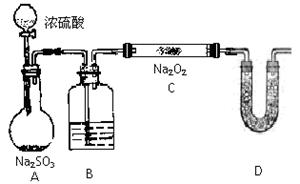
装置中B中的试剂为 ,其作用是
D中的药品为 ,其作用是
(3)为确认SO2和Na2O2反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号)
| A.用带火星的细朩条靠近U形管口,观察细朩条是否着火燃烧 |
| B.将C装置中反应后的固体物质溶于适量水配成溶液 |
| C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成 |
| D.在配成的溶液中先加入盐酸酸化,再加入氯化钡溶液,观察是否有气泡或沉淀生成 |
 (1)步骤③的实验操作名称是;步骤⑤所用实验仪器的名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是。
(1)步骤③的实验操作名称是;步骤⑤所用实验仪器的名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是。
(2)步骤④反应的离子方程式是2I-+MnO2+4H+ = Mn2++I2+2H2O,该反应的氧化剂是,每生成0.5mol I2转移的电子的物质的量为。
(3)步骤⑤中,某学生选择用苯来提取碘的理由是。
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:。
实验室配制480 mL 0.5mol/L的NaOH溶液,请填写下列空白:
(1)本实验所必需的仪器有:天平、药匙、烧杯、玻璃棒、________________、_______________。
(2)配制该溶液需取NaOH晶体________________g。
(3)某同学俯视观察液面,会使所配溶液浓度__________(填“偏高”、“偏低”或“无影响”,下同)。
某同学溶解后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会__________
某同学称量氢氧化钠固体时称量时间过长,所配溶液浓度会__________
(4)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应_____________________。
⑴实验操作中,不慎将手指划破,这时可从急救箱中取FeCl3溶液止血,其原理是。
⑵今有两瓶标签模糊不清,只知道分别盛有淀粉溶液和氯化钠溶液,试用多种方法对其鉴别。(写出其中2种方法,每种2分)
①。
② 。
。
医用氯化钙 可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为:
可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为: 
(1)CaCO3与盐酸反应的离子方程式。
(2)过滤时需用的玻璃仪器除烧杯、玻璃棒外还有。滤渣主要成分的化学式。
(3)酸化时加盐酸的目的为:
①,
②防止Ca2+ 在蒸发时发生水解。
(4)为什么蒸发 结晶要保持在160℃:。
结晶要保持在160℃:。
(5)为测定样品中CaCl2 ·2H2O的含量,称取0.7522g样品并配成250mL溶液,分别取该溶液25.00mL于三个锥形瓶中,用0.04mol/LAgNO3溶液进行三次滴定,消耗 AgNO3溶液的平均体积为20.39mL。
①通过计算,样品中含CaCl2 ·2H2O的质量分数。
②若所测样品 CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为 。
。
有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、NO3-、SO42-、Cl-、HCO3-、Cu2+,取该溶液实验如下:
①取少量该溶液,加几滴石蕊试液, 溶液变红色
②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热, 有无色气体产生,后在空气中又变成红棕色
③取少量该溶液 ,加BaCl2溶液, 有白色沉淀生成
,加BaCl2溶液, 有白色沉淀生成
④取③中上层清液,加AgNO3溶
 液, 有白色沉淀生成,且不溶于HNO3
液, 有白色沉淀生成,且不溶于HNO3
⑤取少量该溶液,加NaOH溶液, 有白色沉淀生成,当NaOH过量时沉淀部分溶解
根据上述实验现象判断:
(1)溶液中肯定存在的离子是。
(2)溶液中肯定不存在的离子是。
(3)为进一步确定可能存在的离子,应该补充的实验是。