(14分)下表是元素周期表的一部分,请回答有关问题:
| 主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
|
|
|
① |
② |
|
③ |
|
| 3 |
|
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
④ |
|
|
|
|
⑩ |
|
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式
(3)④元素与⑦元素形成化合物的电子式
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是
(填化学式)。
(5)③元素与⑩元素两者核电荷数之差是 。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
| 实验步骤 |
实验现象与结论 |
| |
|
侯德榜是我国著名的工业化学家,又是一个伟大的爱国者,他所发明的制碱法为中国化学工业乃至世界化学工业作出了重要的贡献,被誉为“侯氏制碱法”。请你回答以下问题:
(1)“侯氏制碱法”中的“碱”其实不是烧碱,请实际情况出向它的溶液中滴加少量稀盐酸的离子方程式____________________________________。
(2)某同学为了验证 和
和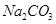 的稳定性,设计了如图甲的实验装置(铁架台、夹持仪器、加热装置等已省略),你认为在X中应放的物质_____________________(填化学式)。
的稳定性,设计了如图甲的实验装置(铁架台、夹持仪器、加热装置等已省略),你认为在X中应放的物质_____________________(填化学式)。
(3)某化学研究性学习小组在老师的指导下,模拟侯德榜先生的制碱原理设计了如图乙的实验装置。
A.实验的操作步骤中,你认为打开旋塞 、
、 的合理顺序应为:先打开______,后打开________(填字母代号)。简述理由____________________________。
的合理顺序应为:先打开______,后打开________(填字母代号)。简述理由____________________________。
B.在盛饱和食盐水的装置中发生反应的离子方程式为________________________;能析出碳酸氢钠晶体的原因是_________(填序号)。
a. 碳酸氢钠难溶于水 b. 碳酸氢钠受热易分解
c. 碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
装置中气胆的作用是___________________________________________________。
C.工业上若需制备纯碱,则上述原料中除了饱和食盐水外,其他原料用工业常用方法制取,写出工业制备两种原料气的主要化学反应方程式__________________。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法:___________________________。
(5)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)=_______________。
某化学兴趣小组模拟测定 、
、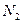 、
、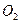 混合气体中
混合气体中 的体积分数,下图是它们在测定中使用的部分实验装置:
的体积分数,下图是它们在测定中使用的部分实验装置:
(1)在答卷的方框中画出所缺实验装置(含试剂)。
(2)当装置①出现________________________现象时,应立即停止通气。若此时没有及时停止通气,则测定的 体积分数_____________(填“偏高”、“偏低”或“不受影响”);若通入气体速度过快,则测定的
体积分数_____________(填“偏高”、“偏低”或“不受影响”);若通入气体速度过快,则测定的 体积分数__________(填“偏高”、“偏低”或“不受影响”)
体积分数__________(填“偏高”、“偏低”或“不受影响”)
(3)装置①中发生反庆的离子方程式为____________________________。
(4)你认为下列试剂中,可以用来代替试管中碘的淀粉溶液的是________(填编号)
A.酸性 溶液 溶液 |
B.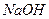 溶液 溶液 |
C.溴水 | D.氨水 |
(5)若碘溶液的浓度为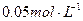 、体积为10mL,收集到的
、体积为10mL,收集到的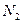 和
和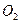 的体积为148.8mL(已折换为标准状况下的体积),
的体积为148.8mL(已折换为标准状况下的体积), 体积分数为___________。
体积分数为___________。
某研究小组在查阅资料中发现,常温下氯气可以氧化氨气获得氮气。该小组由此设计出制取氮气的思路,设计装置图如下。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置A中的烧瓶内固体不可以选用_________(填序号)。
A.生石灰 B.碱石灰 C.五氧化二磷 D.烧碱
(2)装置F发生反应的离子方程式是___________________________。
(3)B装置的作用_________;E装置的作用__________________。
(4)写出制取 的化学方程式__________________;反应生成
的化学方程式__________________;反应生成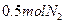 ,转移的电子数是_________
,转移的电子数是_________ 。
。
(5)当反应装置里的氨气和氯气的物质的量之比大于_________时,尾气里一定含有氨气;当反应装置里的氯气和氨气的物质的量之比大于_________时,尾气里一定含有氯气。
(16分)
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.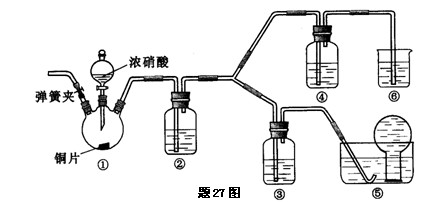
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应.2NO2+2NaOH=NaNO3+NaNO2+H2O(1)装置①中发生反应的离子方程式是.
(2)装置②的目的是,发生反应的化学方程式是.
(3)实验应避免有害气体排放到空气中,装置③、④、⑤、⑥中盛放的药品依次是
.
(4)实验的具体操作是:先检验装置的气密性,再加入药品,然后打开弹簧夹,通入
目的是.
(5)该小组得出的结论所依据的实验现象是.
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应.2NO2+2NaOH=NaNO3+NaNO2+H2O (1)装置①中发生反应的离子方程式是.
(2)装置②的目的是,发生反应的化学方程式是.
(3)实验应避免有害气体排放到空气中,装置③、④、⑤、⑥中盛放的药品依次是
.
(4)实验的具体操作是:先检验装置的气密性,再加入药品,然后打开弹簧夹,通入
目的是.
(5)该小组得出的结论所依据的实验现象是.