已知某“84消毒液”瓶体部分标签如右所示,该“84消毒液”通常稀释到100倍(体积之比)后使用。请回答下列问题:
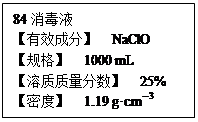
I(1)该“84消毒液”的物质的量浓度约为__________mol·L-1(小数点后保留一位)。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)为__________ mol·L-1。
II某同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。实验步骤如下:
① 将烧杯中的溶液转移至容量瓶中;
② 计算并称量所需的NaClO固体;
③ 向容量瓶中加蒸馏水至液面与刻度线相平;
④ 将NaClO加入100mL 烧杯中,并加适量水溶解;
⑤ 洗涤烧杯和玻璃棒2次,洗涤后溶液转移至容量瓶中;
⑥ 振荡摇匀;
⑦ 颠倒摇匀。
(1)完成上述实验,下图所示的仪器中,还需要添加的玻璃仪器是 。
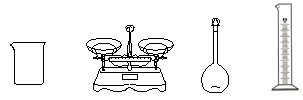
(2)步骤②中计算所需要NaClO的质量为 g;
(3)实验的先后顺序应为 (填写序号);
(4)在步骤①中,为防止溶液溅出,应采取的措施是 ;
(5)在进行步骤③的实验操作时应注意的问题是 ;
(6)配制溶液时,下列实验操作会使配制溶液浓度偏高的是 。
| A.容量瓶内有水,未经过干燥处理 |
| B.进行步骤③操作时,俯视刻度线 |
| C.缺少步骤⑤ |
| D.定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线 |
E.缺少步骤⑥
乙醇的沸点是78℃,能与水以任意比例混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的反应原理是 

(1)图甲和乙是两套实验室制乙醚的装置,选装置最合适,理由是__。
(2)反应液中应加入沸石,其作用是。
(3)反应中温度计水银球的位置是 __________________。
(4)用装置乙制得的乙醚中可能含有大量的杂质,这杂质是,除去这种杂质的简易方法是。
(5)如果温度太高将会有乙烯生成,该反应的化学方程式是
,反应类型是。
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为 2NH3+3CuO N2+3H2O+3Cu,用示意图中的装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C中的固体是氧化铜。回答下列问题:
2NH3+3CuO N2+3H2O+3Cu,用示意图中的装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C中的固体是氧化铜。回答下列问题:
(1)A中发生反应的化学方程式是。
检验氨气通常采用的方法是_________,其现象是__________。
(2)B中加入的物质是,其作用是。
(3)实验时C中观察到的现象是,该反应中氨的作用是_______(填氧化剂或还原剂)。
(4)实验时在D中收集到的液态物质是,E中收集到的气体是__________。
(5)若要检验反应生成的水,可将试管D及装冰水的烧杯部分改成下图装置,U形管X内装有____________,现象是________________;干燥管Y内装有碱石灰,作用是_______________________________________。
(10分)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。 实验室里从海藻中提取碘的流程如下图所示:
(1)指出提取碘的过程中有关的实验操作名称:①____________③__________; 写出过程②中有关反应的离子方程式。
(2)提取碘的过程中,可供选择的有机试剂是。
(A)甲苯、酒精 (B)四氯化碳、苯 (C)汽油、乙酸 (D)汽油、甘油(3)灼烧时,除需要三脚架外,还需要用到的实验仪器是;
A.烧杯 B.坩埚
C.表面皿 D.泥三角
E.酒精灯 F.干燥器
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出下图实验装置中的错误之处(任二处)①②。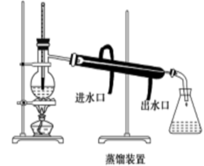
某活动小组进行实验室制取硝基苯和溴苯的实验,
(1)写出制取硝基苯的化学方程式______________________
写出制取溴苯的化学方程式______________________
(2)两个实验中除苯外,还需选用哪些药品_______________(可以多选)
A 溴水 B 液溴 C 浓硝酸 D稀硝酸
E 浓硫酸 F 稀硫酸 G Fe粉 H 氯化铁
(3)用如图所示装置制取硝基苯时,长玻璃导管的作用是_________。
(4)纯净的溴苯是无色,密度比水大,不溶于水的液体,因溶有溴而呈褐色,可加入_____________溶液洗涤除去其中的溴,写出该溶液除去溴的反应的化学方程式________________________________。
(共22分)某实验小组用下列装置进行如下的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
、。
实验小组在不断鼓入空气的情况下,熄灭酒精灯,发现反应仍能继续进行,说明该反应是 反应。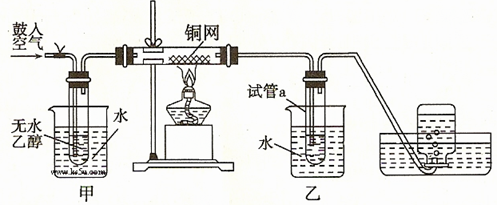
(2)甲和乙两个水浴作用不相同。甲的作用是;
乙的作用是。
(3)反应进行一段时间后,干燥的試管a中能收集到不同的物质,那么收集到的有机物是(请填写其结构简式);集气瓶中收集到的气体的最主要成分是。(填写气体的分子式)
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,实验小组的同学认为这可能是存在副产物乙酸。除去该物质,可以使用厨房中常见的一种化合物,该物质为 。(填写化学式或分子式)
。(填写化学式或分子式)
(5)请写出以上实验涉及的有机物乙醇在生活生产中的一种具体应用:。
(6)该实验的目的是: