取一定质量的下列各组物质混合后,无论以何种比例混合,其充分燃烧后二氧化碳和水的质量不变且二者物质的量相同的是 ( )
| A.C2H2 C6H6 | B.CH4 C3H8 | C.C3H6 C3H8 | D.C2H4 C4H8 |
向淀粉中加入少量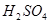 ,并加热使之水解。为测定淀粉的水解程度,所需下列试剂最恰当的组合是
,并加热使之水解。为测定淀粉的水解程度,所需下列试剂最恰当的组合是
①NaOH溶液 ②银氨溶液③新制的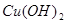 ④碘水⑤
④碘水⑤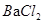 溶液
溶液
| A.①⑤ | B.②④ | C.①③④ | D.②③④ |
以2—氯丙烷为主要原料,制取1,2—丙二醇时,需要经过的反应先后分别为
| A.加成—消去—取代 | B.取代—加成—消去 |
| C.取代—消去—加成 | D.消去—加成—取代 |
设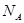 为阿伏加德罗常数,下列有关叙述正确的是
为阿伏加德罗常数,下列有关叙述正确的是
A.标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为(7/22.4)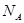 |
B.1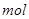 羟基( 羟基(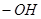 )所含的电子总数为10 )所含的电子总数为10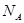 |
| C.硝化甘油、火棉、TNT都是硝酸酯 |
D.1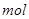 碳正离子( 碳正离子(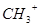 )所含的电子总数为8 )所含的电子总数为8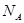 |
下列实验能成功的是
A.用3体积的乙醇与l体积的浓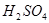 混合加热到170 混合加热到170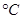 制乙烯 制乙烯 |
| B.加入适量浓溴水除去苯中混有的少量苯酚 |
C.用饱和食盐水和电石( )在启普发生器中制乙炔 )在启普发生器中制乙炔 |
| D.以硫酸、碳酸钠、苯酚钠溶液为试剂,验证酸性强弱关系:硫酸>碳酸>石炭酸 |
下列说法或鉴定溴乙烷中溴元素存在的最佳操作是
A.甲酸与氢氧化钠溶液反应生成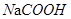 |
B.加蒸馏水,充分搅拌后,加入 溶液 溶液 |
C.加入NaOH溶液,加热后再加入稀硝酸酸化,然后加入 溶液 溶液 |
D.加入NaOH的乙醇溶液,加热后再加入 溶液 溶液 |